日本リウマチ財団ニュース
No.177号2023年3月号
国際学会報告書
日本リウマチ財団ニュース177号に掲載しています「アメリカリウマチ学会(ACR)2022学会速報 」のロングバージョンです。
田巻 弘道 氏
聖路加国際病院 Immuno-Rheumatology Center 医長
責任編集:岡田 正人
医療情報委員会委員
聖路加国際病院 Immuno-Rheumatology Center
はじめに
2022年11月10日から14日まで、ACR Convergence 2022がフィラデルフィアで開催された。前回並びに前々回は完全オンラインでの開催であったが、今回は現地とWebとのハイブリッドでの開催となった。セッションによって、オンラインのみ、現地のみ、あるいはハイブリッドと分かれていた。筆者は久々にアメリカの地を踏み、現地にて参加したが、さまざまな人との交流はやはりオンラインだけでは味わえないものであり、集まって行うことができることの嬉しさを感じた。今回は、ポスター発表はオンラインのみであったが、ポスターの前で、世界の大御所達と議論ができる日を楽しみにしている。
今回もいつものように筆者の独断と偏見で選んだ興味深い報告を紹介させていただく。
The Great Debate: 13S127:To Treat or Not? The Role of DMARDS in Subclinical Rheumatoid Arthritis
近年、血清反応陽性関節リウマチの発症機序が解明されるに従い、発症してから治療するというのではなく、予防することが可能かという議論がよく行われる。関節リウマチは遺伝的素因のある個人に環境因子が加わり、局所そして全身の自己免疫(リウマチ因子や抗CCP抗体にて測定される)の出現、潜在性関節炎(診察で関節炎がないが関節痛がある状況)、分類不能関節炎(関節炎はあるものの関節リウマチの分類基準を満たさない)、そして分類可能な関節リウマチ(関節リウマチの分類基準を満たす関節炎)へと進展していくとされる。臨床的には自己免疫が形成されている段階で、疲労、倦怠感などといった非関節症状が出現、その後、関節症状が出現するとされている。今回の議論ではDMARDsで治療すべきという立場から、アメリカ・コロラド大学のMichael Holers医師とKevin Deane医師が、治療すべきでないという立場からカナダのマニトバ大学Hani El-Gabalawy医師とウェスタンオンタリオ大学Janet Pope医師が発表を行っていた。 治療すべきとの立場からは、以下のポイントが考慮すべきこととして挙げられた。
- 関節リウマチは発症すると大抵は永続的に持続する
- 現在の関節リウマチの治療の効果は限定的である
- 多くの人は関節リウマチになりたくない
- 関節リウマチになると個人のレベルでも集団レベルでもお金がかかる
- 関節リウマチは健康や死亡率に悪影響を与える
- 関節リウマチが予防できなくても、治療することでその後の関節リウマチがより軽症になる可能性がある
- 関節の炎症のない段階で治療することで、痛みや倦怠感などの観点から利益があるかもしれない
現時点では有効で確立された治療法はないものの、自己免疫が起きてくるところから関節炎が発症するまでのそれぞれの段階の生物学的機序を解明し、それぞれの段階に応じた介入をすることで、上記に挙げられた関節リウマチを発症させないことによるメリットを説いていた。個人のレベルでさまざまな介入ポイントがあることが予想されるが、特に今後さらに科学的にこの分野を進展させる必要がある、未来へ向けたメッセージとなっていた。 治療すべきではないという立場からは、科学的に今後この領域は発展させていく必要があることに関しては同意するものの、2022年の段階では治療すべきではないという点に関して同じデータを違う角度からみた論点を展開していた。
まずは、リウマチ医と患者の会話を示しながら、実際の会話の内容に加えて会話には出てこないが心の内を併記した内容で以下のポイントを示していた。 - CCP抗体陽性でも全員が関節リウマチを発症するというわけではない
- 抗CCP抗体が陰性になってしまう人も一定の割合でいる
- 現在ある薬物療法では予防ができることを示したものがない (表1)
表1. 関節リウマチ予防の主な臨床試験一覧
| 試験名 | 対象 | 介入 | 結果 |
|---|---|---|---|
| APIPPRA | 関節痛+RF/CCP | Abataceptを毎週125㎎皮下注を1年間 | 進行中 |
| ARIAA | 関節痛 CCP MRIで炎症 |
Abataceptを毎週125㎎皮下注を6か月 | 最終結果が出ていないが、進行を遅らせたり予防できる可能性あるかも。最終結果待ち。 |
| TREAT EARLIER | 関節痛+MRI | メチルプレド二ゾロン120㎎筋注1回+MTX25㎎毎週を12か月 | RAの発症を抑えないが、症状は和らげる |
| STAPRA | RF/CCP陽性 | アトルバスタチンを40㎎毎日を36か月 | 予防や進行を遅らせることなし |
| StopRA | CCP陽性 | ヒドロキシクロロキンを12か月 | 予防や進行を遅らせることなし |
| Dutch dexamethasone | 関節痛+RF/CCP | Dexamethasone100mg at baseline and 6 weeks | 予防や進行を遅らせることなし |
| PRAIRI | 関節痛+RF+CCP US/MRI subclinical synovitis or CRP0.6mg/L |
リツキシマブ1000mg1回投与 | 発症を遅らせるが、予防効果なし |
Bos et al Ann Rheum Dis 2010
Gerlag et al Ann Rheum Dis 2019
van Boheemen et al RMD Open 2021
Krijbolder et al Lancet 2022
Al-Laith et al Trials 2019
Rech et al ACR 2022 Abstract 0530
- 生活習慣の変更やビタミンD内服などの介入で予防効果が期待できる
- 患者側は副作用の出る可能性のある薬剤を始めるよりも、生活習慣改善などを望むことが多い
また、自己免疫は介入しようとした時点ではもう不可逆的な段階に来てしまっている可能性、抗体陰性の関節リウマチが3~4割いる中で抗体による予測は多くの潜在的な関節リウマチを発症してくる患者を検知できない可能性があることなどを挙げていた。最後には、健康的な生活習慣で35%の関節リウマチのリスクを減らせるデータを示し、また抗CCP抗体高値陽性患者の5人に4人は次の年に発症しないことを考えると、治療することはその4人を無益な治療によるリスクに晒すことを示して議論を締めくくった。
二つの立場をみていくと、前者は基礎研究、トランスレーショナルリサーチをする立場からの将来的な展望を見据えた議論であるというのに対して、後者は現実的な臨床の立場から現時点では有効な方法がない状況を示していた。今後、予防が可能になるための超えるべき研究の課題が明らかになるとても良い議論であったと感じた。
2.ACR Guidelines for Vaccination: 12S136
SARS-CoV-2の流行に対してワクチン接種が行われるようになり、ワクチンへの注目が高まっている。その中でもとりわけリウマチ科医の関心が高いこととして、免疫抑制剤内服者に有効にワクチン接種するための戦略が挙げられる。SARS-CoV-2以外のワクチンに関してのガイドラインがACR 2022で発表された。アメリカでのガイドラインなので実際に日本では適用上難しいこともあること、日本での実際の運用は添付文書の範囲内で行うことをお勧めすること、並びに正式にまだ出版されていないことに注意いただきたい。このことを前提とし、3つに限定して気になるポイントを取り上げる。
①インフルエンザはタイミングを逃さずに、打てるときに打つ。メトトレキサートに関しては接種後2週間休む
メトトレキサートの休薬に関しては、休薬期間が1週間でも良いのではないかという発表が今回のACRであった。(Abstract 0936)
②65歳未満でも、免疫抑制剤を使用する患者では肺炎球菌ワクチンを打つ
現在、日本ではPPSV23とPCV13が手に入るが、アメリカではPCV15やPCV20が手に入るようになっており、PCV15の場合にはその後PPSV23の追加接種、PCV20の場合には単独の接種が勧められている。
リツキシマブ使用時には、PCV13をday 0と7に接種後、5ヵ月後にPPSV23を接種するというやり方が、PCV13をday 0に接種後、5ヵ月後にPPSV23を接種するというやり方より抗体のつきが良かったという発表があった。(Abstract L16)
③母がTNF阻害薬を妊娠中に使用していた場合の、児に対するロタワクチンの接種は条件付き推奨されている
児が子宮内で母の使用するTNF阻害薬に暴露された際に、児のBCGワクチン接種に伴い播種性BCGを発症したという症例報告がある1)。このため、胎内でTNFに暴露した児に対して出生後6ヵ月は生ワクチンを避けるのが勧められてきた。ロタワクチンに関しては、3つの観察研究で58名の児が生物学的製剤に暴露され、ロタワクチンでの有害事象は認めなかったという少数の報告に基づいている。
ガイドラインの全容に関しては、表2を参照にしていただきたい。
表2 ACRのリウマチ性疾患を持つ患者に対するワクチンのガイドライン
| 特定のワクチンの免疫抑制剤使用下の推奨 |
|---|
| 65歳以上、18歳を超え65歳未満で免疫抑制剤内服中のRMD患者は、通常用量のインフルエンザワクチンより、高用量あるいはアジュバント化インフルエンザワクチンを条件付きで推奨する。もし高用量やアジュバント化したインフルエンザワクチンが手に入らないのであれば、ワクチンをしないよりは、どのタイプのインフルエンザワクチンでも使用する方が好ましいし、ワクチンを遅らせるよりも、今日打つ方が良い |
| 65歳未満のRMD患者で、免疫抑制剤内服中であれば、肺炎球菌ワクチンの摂取が強く推奨される |
| 18歳を超えるRMD患者で免疫抑制剤内服中のものは、不活化帯状疱疹ワクチンが強く推奨される |
| 26歳を超え、45歳未満のRMD患者で免疫抑制剤を飲んでる場合で以前にHPVワクチン接種がない場合は、HPVワクチンを条件付きで推奨する |
非生ワクチン投与時の薬剤のマネジメント
| インフルエンザワクチン | 他の非生ワクチン | |
|---|---|---|
| メトトレキサート | ワクチンの後2週間メトトレキサート を中断* | メトトレキサートを継続 |
| リツキシマブ | リツキシマブを継続** | ワクチンを次のリツキシマブ投与予定日に合わせて行い、ワクチン後リツキシマブを最低2週間遅らせる |
| その他の免疫抑制剤 | 免疫抑制剤を継続 | 免疫抑制剤を継続する |
*病勢が許すのであれば中断、投与の機会を失わないように非リウマチ医は投与してからリウマチ医にメトトレキサートを中断して良いか相談
**予定通りにインフルエンザワクチンを投与。その後のリツキシマブを最低でも2週間病勢が許すのであれば遅らせる全て条件付き推奨
海外での推奨ですので、実際の投与は日本の添付文書を参考にしてください
ACR convergence 2022 12S136 https://www.rheumatology.org/Portals/0/Files/Vaccinations-Guidance-Summary.pdf
糖質コルチコイド投与中の非生ワクチン投与タイミング
| インフルエンザワクチン | 他の非生ワクチン | |
|---|---|---|
| プレドニゾロン≦10mg/日と同等量 | 投与 | 投与 |
| プレドニゾロン>10mg/日でプレドニゾロン<20mg/日と同等量 | 投与 | 投与 |
| プレドニゾロン≧20mg/日と同等量 | 投与 | 延期** |
**プレドニゾロン換算 <20mg/日 になるまで延期する
| 生ワクチン使用時の免疫抑制剤のマネジメント |
|---|
| RMD患者で免疫抑制剤を使用している場合は、生ワクチンは延期することが条件付きで推奨される |
| RMD患者では、免疫抑制剤を下表の期間生ワクチン投与前に中断し、生ワクチン投与後4週間中断することを条件付きで推奨する |
海外での推奨ですので、実際の投与は日本の添付文書を参考にしてください
ACR convergence 2022 12S136 https://www.rheumatology.org/Portals/0/Files/Vaccinations-Guidance-Summary.pdf
| 投与前中断期間 | 投与後中断期間 | |
|---|---|---|
| 糖質グルココルチコイドa | 4週 | 4週 |
| メトトレキサート 、アザチオプリンb | 4週 | 4週 |
| レフルノミド、ミコフェノール酸モフェチル、カルシニューリン阻害薬、経口シクロホスファミド | 4週 | 4週 |
| JAK阻害薬 | 1週 | 4週 |
| TNF, IL17, IL12/23, IL23, BAFF/BLyS阻害薬 | 1投与サイクルc | 4週 |
| IL6経路阻害薬 | 1投与サイクルd | 4週 |
| IL1阻害薬 | 1投与サイクルd | 4週 |
| アバタセプト | 1投与サイクルc | 4週 |
| アニフロルマブ | 1投与サイクルc | 4週 |
| 静注シクロホスファミド | 1投与サイクルc | 4週 |
| リツキシマブ | 6ヶ月 | 4週 |
| IVIG e 300-400mg/kg 1gm/kg 2gm/kg |
8ヶ月 10ヶ月 11カ月 |
4週 4週 4週 |
a プレドニゾロン換算<20mg/日または体重10kg未満の場合は<2mg/kg/日、隔日投与の場合、もしワクチンがとても重要で病気の悪化や副腎不全のリスクが高ければ、これらの低容量は継続しても良い。
b メトトレキサート≦0.4mg/kg/週またはアザチオプリン≦3mg/kg/日の内服の場合、ワクチンが重要で免疫抑制剤なしでの病気の悪化のリスクが高い場合中断期間を短くしても良い。
c 投与間隔が二つ以上承認されている場合、長い方の投与サイクルを用いること
d 小児の自己炎症性疾患あるいは全身型JIAでワクチンが重要であれば、生物学的製剤中断により病気の悪化のリスクが高い場合、中断期間を短くすることを考慮できる
e ワクチン前にIVIGを中断するのは、安全性のためではなく、効果を増強させるためである。状況によっては、麻疹が流行っている場合など、早期のワクチンが遅らせるよりも好ましい場合がある
海外での推奨ですので、実際の投与は日本の添付文書を参考にしてください
ACR convergence 2022 12S136 https://www.rheumatology.org/Portals/0/Files/Vaccinations-Guidance-Summary.pdf
子宮内で免疫抑制剤に暴露した乳児にロタウィルス生ワクチンを投与するタイミング
| 妊娠第2期、3期での薬剤暴露 | 生まれて最初の6ヶ月以内 | 生まれて6ヶ月後以降 |
|---|---|---|
| TNF阻害薬 | ロタウィルスワクチンを投与 | |
| リツキシマブ | ロタウィルスワクチンを投与しない | ロタウィルスワクチン投与 |
海外での推奨ですので、実際の投与は日本の添付文書を参考にしてください
ACR convergence 2022 12S136 https://www.rheumatology.org/Portals/0/Files/Vaccinations-Guidance-Summary.pdf
3.2022アメリカリウマチ学会ステロイド性骨粗鬆症の予防と治療のガイドライン
糖質グルココルチコイドの内服により骨粗鬆症のリスクの増大、骨折のリスクの増大があることは幅広く知られていることである。グルココルチコイドによる治療を行う際には、骨粗鬆症のリスクをしっかりと推定し、必要であれば骨折予防のために治療を行う必要がある。2017年にACRのステロイド性骨粗鬆症のガイドラインは発表されていたが、今回はそれの改訂となる。全体の情報は図1を参照していただけたらと思う。
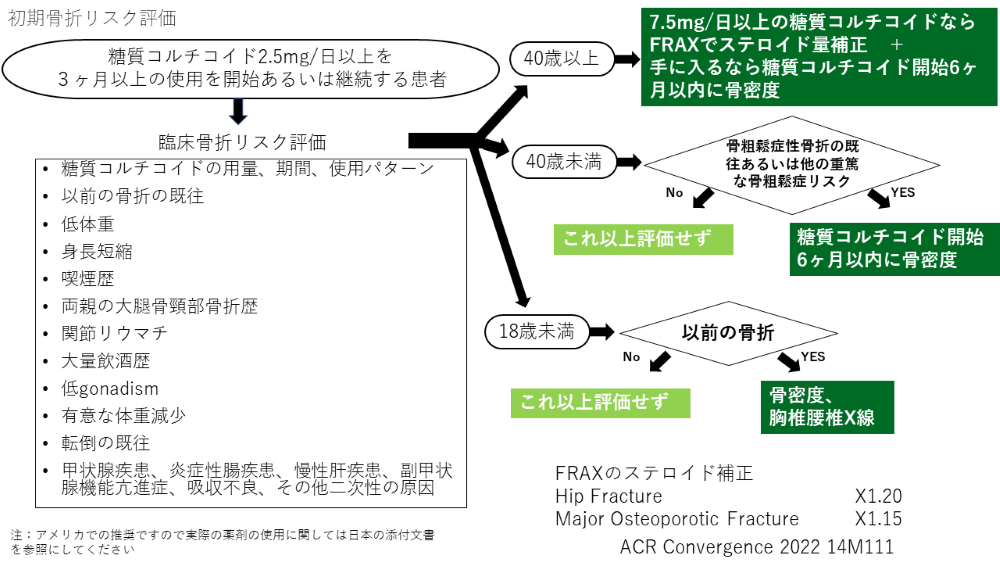
注:アメリカでの推奨ですので実際の薬剤の使用に関しては日本の添付文書を参照してください
治療の推奨
| 高リスク | 中リスク | 低リスク |
|---|---|---|
| 骨折データに基づいて経口のビスホスホネートを強く推奨する | 条件付きで、患者の好みや合併症を考慮し、経口/点滴ビスホスホネート、デノスマブ、PTH/PTHrPを推奨する | 臨床的骨折リスク評価を毎年行うことを強く推奨する |
| 条件付きで、点滴ビスホスホネート、デノスマブ、PTH/PTHrPを推奨する | 条件付きで、カルシウム、ビタミンD、生活習慣改善 | DEXA、VFAまたは椎体の画像を1-2年ごとに行うことを強く推奨する |
| 条件付きで、カルシウム、ビタミンD、生活習慣改善 | 条件付きでSERM、ロモソズマブを推奨しない(心血管病、脳卒中、血栓症のため) | 条件付きで、薬物療法よりもビタミンDとカルシウムを推奨する |
| 条件付きでSERM、ロモソズマブを推奨しない(心血管病、脳卒中、血栓症のため) | 条件付きで、生活習慣改善、運動、アルコールの制限、禁煙を推奨する |
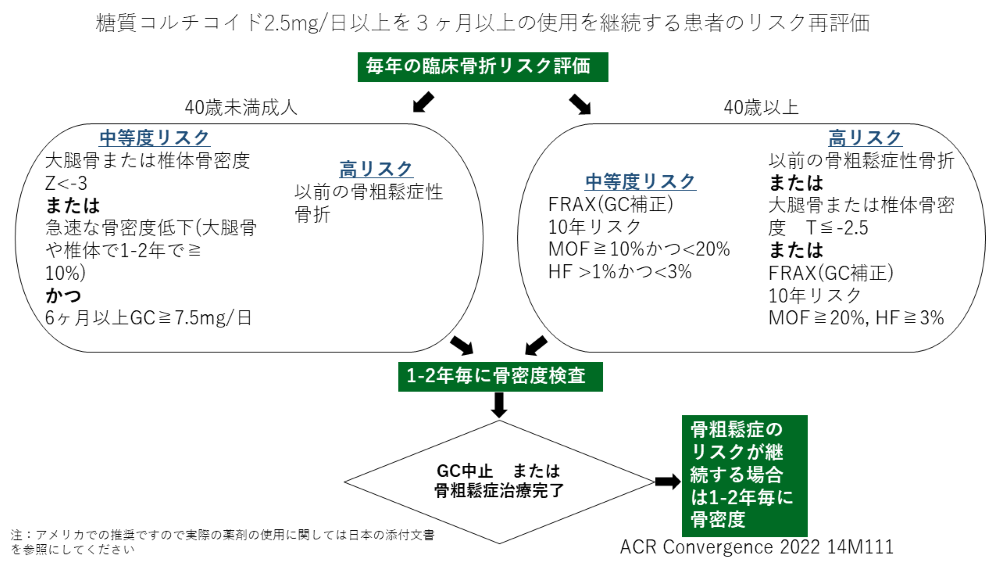
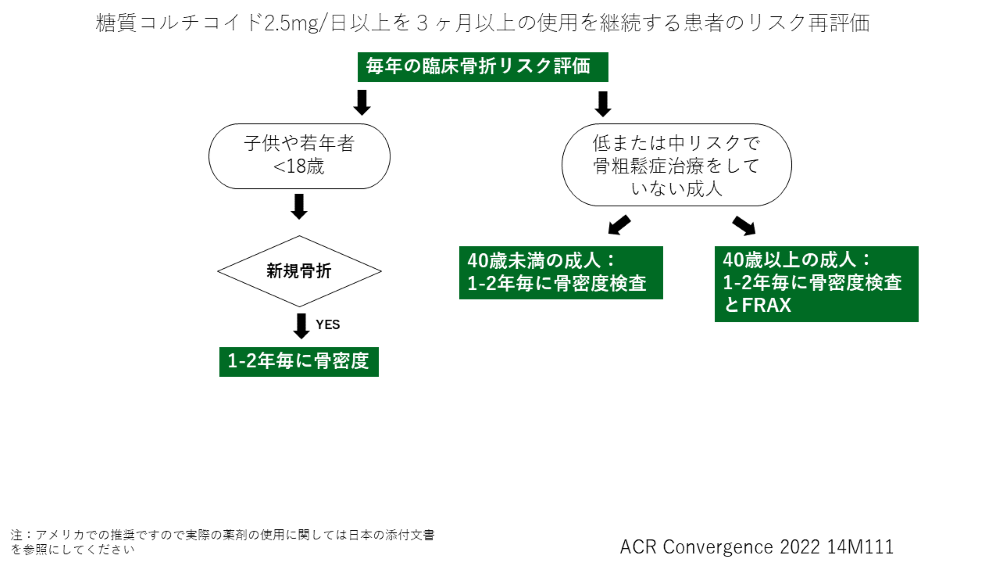
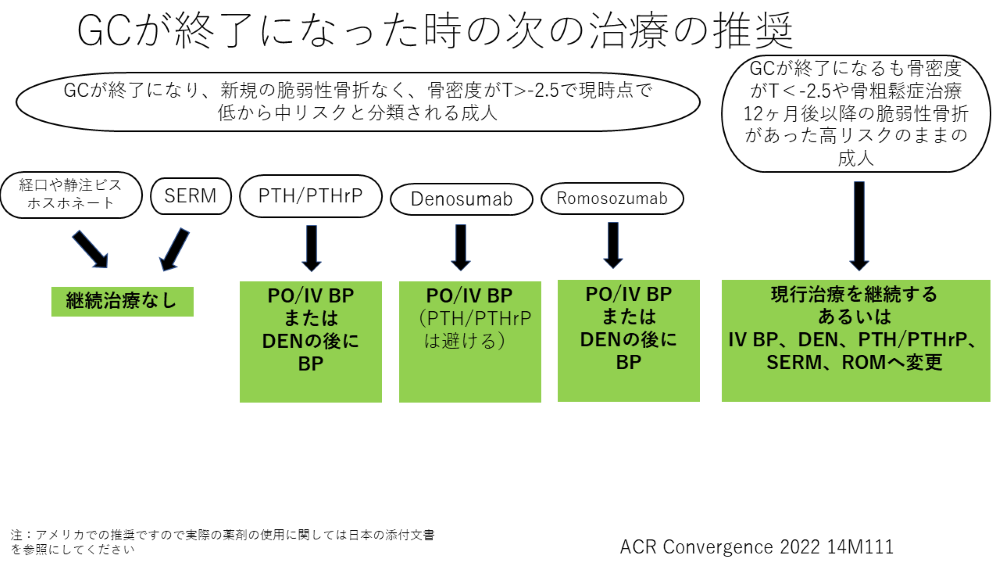

ここでは40歳以上の患者での流れを簡単に説明する。
3ヵ月以上糖質グルココルチコイドをプレドニゾロン換算で2.5mg/日以上を3ヵ月以上使用する様な場合には骨折のリスクの臨床的評価を行う。40歳以上ではFRAXを使用し、プレドニゾロン換算で7.5mg/日以上使用している場合はFRAXは骨折のリスクを低く見積もってしまうので、Major fractureのリスクは1.15倍、大腿骨頸部骨折のリスクは1.2倍して補正する。FRAXによりリスクは高リスク(以前の脆弱性骨折あるいは骨密度でT score ≦-2.5または補正したFRAXでMajor fracture risk ≧20%、大腿骨頸部骨折≧3%)、中リスク(Major fracture 10-20%, 大腿骨頸部1-3%)、低リスク(Major fracture risk <10%、大腿骨頸部骨折< 3%)と分けることができる。基本的には中リスク以上は薬物療法の対象となる。
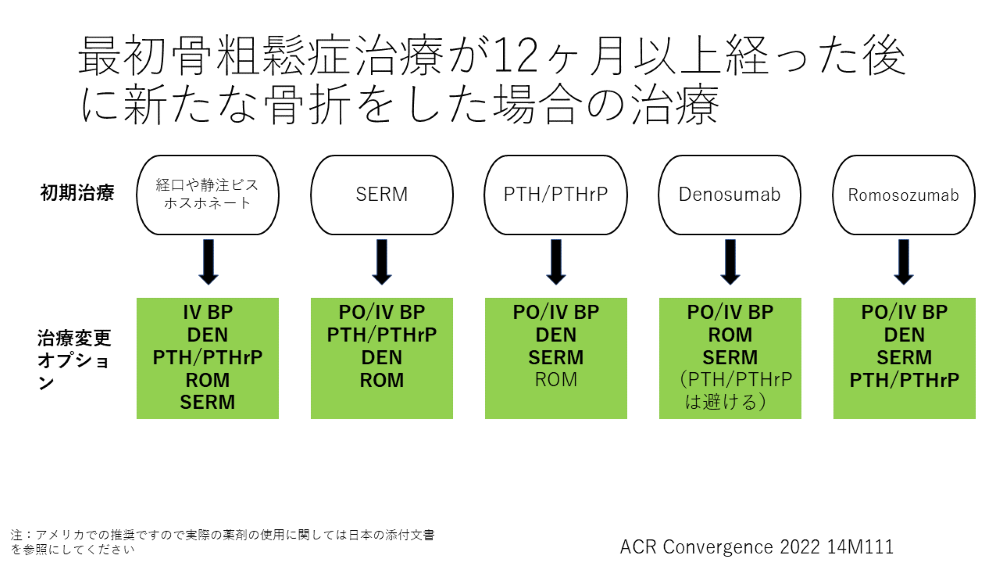
今回のガイドラインで大きく追加された部分は以下の2点となる。
①薬物療法を12ヵ月以上使用しているなかで新規骨折が発症した場合にどの様な薬剤へ変更するか
②糖質グルココルチコイドが終了となった際に、リスクに基づいて治療薬をどの様にするのか
基本的には薬剤の変更の際の注意点はデノスマブを使用していた場合には、股関節の骨密度の低下のリスクを考え、PTHやPTHrP製剤への変更は避けるべきであるということ、また、糖質グルココルチコイド終了時に骨折リスクが低リスクであれば、ビスホスホネートやSERMを使用していた場合はそのまま中断できるが、デノスマブ、テリパラチド、アバロパラチド、ロモソズマブなどを使用していた場合は、薬剤の中断とともに骨密度の低下を起こしてしまうので、ビスホスホネートなどを投与後に中断をすることを考慮する。
4.抗リン脂質抗体症候群の分類基準案 13S150
元々のSapporo基準は、臨床兆候が血栓症あるいは産科的合併症に限られ、また血液検査の所見も12週明けて2度陽性にならなければならないという基準であった。実際の抗リン脂質抗体症候群では、劇症型の様に2度血液検査による測定を行う以前に不幸な臨床的な転機をとってしまう様な場合や、血栓症や産科的合併症以外の臨床兆候をきたす場合もあったりする。また、抗体の中でもリスクが高いものと低いものの重み付けがなされていないことや、元々血栓症のリスクも元来の基準では考慮されていなかった。
今回の新しい分類基準では臨床の領域が6領域ある。静脈、動脈の血栓症では元々のリスクがある場合とない場合で点数の重み付けが変えられている。また、臨床兆候からの疑いのみなのか、画像や病理で確認できているのかでも重み付の差がつけられてる。さらに、抗体検査の結果もその抗体価や種類によって重み付けがなされる様になった。
臨床ドメインと検査ドメインでそれぞれ3点以上あれば分類基準を満たすということである。分類基準の当てはめ方、その項目や点数に関しては図2を参照にしていただきたい。
図2 ACR/EUALR APS syndrome classification criteria

| 臨床ドメイン |
|---|
MacrovascularD4. 産科D1. 静脈血栓塞栓症D2. 動脈血栓>3回続く胚損失(<10w)and/or 胎児死亡(10w0d-15w6d)1VTE+高VTEリスク1動脈血栓+高CVDリスク2重篤なPECやPIのない胎児死亡(16w0d-33w6d)1VTEで高VTEリスクなし3動脈血栓で高CVDリスクなし4胎児死亡ありまたはなしのPECまたはPI(どちらか重篤な兆候あり、>34w0d)3Microvascular
胎児死亡ありまたはなしのPECかつPI(どちらも重篤な兆候あり、>34w0d)4D3. 疑いD3. 確定D5. 心臓の弁
Livedo racemosa(診察)2
5肥厚2リベド血管障害(診察)2リベド血管障害(診察と病理)5疣贅4急性/慢性aPL腎症(診察/検査)2急性/慢性aPL腎症(病理)5D6. 血液肺胞出血(症状と画像)2肺胞出血(BAL/病理)5血小板減少(20-130×109/L)2
心筋症(画像/病理)5
副腎出血(画像/病理)5
| 検査ドメイン | |||||
|---|---|---|---|---|---|
| D7. 凝固ベースの機能アッセイによるaPLテスト-LAテスト | D8. 固相アッセイによるaPL – aCL ELISA and/or aβ2GPI ELISA(継続的) | ||||
| LA陽性(single-1回のテスト) | 1 | 中から高値陽性 | IgM | aCL かつ/または aβ2GPI | 1 |
| LA陽性(継続的) | 5 | 中等度陽性 | IgG | aCL かつ/または aβ2GPI | 4 |
| 高値陽性 | IgG | aCL または aβ2GPI | 5 | ||
| 高値陽性 | IgG | aCL かつ aβ2GPI | 7 | ||
| 高VTEリスク | ELISAで中等度陽性(40-79U)、高値陽性(>80U) | ||
|---|---|---|---|
| 主要VTEリスクファクター(1つ以上) | マイナーVTEリスクファクター(2つ以上) | 略語 | |
| ・悪性腫瘍あり | ・活動性の自己免疫性疾患あるいは活動性の炎症性腸疾患 | aPL: リン脂質抗体 | |
| ・入院 | ・急性/活動性重篤な感染症 | aCL: 抗カルジオリピン抗体 | |
| ・大外傷 | ・中心静脈カテーテル | aβ2GPI : 抗β2グリコプロテインI抗体 | |
| ・高リスク手術 | ・ホルモン補充療法、エストロゲン経口避妊薬、IVF | BAL:肺胞洗浄 | |
| ・長距離旅行 | CVD:心血管病 | ||
| ・妊娠または出産後 | LA: ループスアンチコアグラント | ||
| ・長期の不動あるいは低リスク手術 | EC:pre-eclampsia | ||
| 高CVDリスク | PI:胎盤不全 | ||
| 高CVDリスクファクター(1つ以上) | 中等度CVDリスクファクター(3つ以上) | VTE:血栓塞栓症 | |
| ・重症高血圧 | ・非重症高血圧 | ||
| ・長期の糖尿病 | ・糖尿病 | ||
| ・重症脂質異常症 | ・中等症脂質異常症 | ||
| ・慢性腎不全 | ・現在の喫煙 | ||
| ・肥満高値 | |||
ACR convergence 2022 13S150
5.その他
その他にも、CPPDの分類基準案(14M158)、ACR 関節リウマチに対する統合的介入のガイドライン(理学的、心理的、心身的、栄養的介入)(13S161)(表3)、ACR/AAHKSガイドライン:人工膝関節や人工股関節にいつ踏み切るかあるいはいつ保存的加療とするか(13S145)などがあった。今後正式に論文化されるのが待ち遠しい内容である。
表3 2022 ACR guideline for exercise, rehabilitation, diet and additional integrative intervention for Rheumatoid Arthritis
| ACR2022 運動、リハビリテーション、食事、その他の統合的介入のガイドライン | |
|---|---|
| 運動 | 食事 |
| ◆着実な運動への関与は運動しないことよりも強く推奨される | ◆条件付きで、地中海スタイルの食事を順守することを勧める |
| ◆条件付き推奨として以下のうちの一つあるいはそれ以上のが勧められる | ◆条件付きで、その他の公式的に定義された食事法は勧めない |
| ✓有酸素運動 | ◆条件付きで、サプリなしで確立された食事法に従うことを推奨する |
| ✓水中運動 | |
| ✓抵抗運動 | |
| ✓心と体の運動(例:ヨガ、太極拳、気功など) | |
| リハビリテーション | その他の統合的介入 |
| ◆条件付きで以下を推奨 | ◆条件付きで以下を推奨 |
| ✓手の治療的運動 | ✓標準化セルフマネージメントプログラム |
| ✓副木固定, 装具、圧迫、ブレイス、テーピング | ✓認知行動療法や心身的アプローチ |
| ✓関節保護テクニック | ✓鍼治療 |
| ✓活動のペース配分、energy conservation, 活動の修正、倦怠感のマネージメント | ✓マッサージ治療 |
| ✓補助器具 | ✓温熱法 |
| ✓補装具 | |
| ✓環境適合 | |
| ✓職業リハビリテーション | |
| ✓職場の評価並びに改善 | |
| ◆条件付きで以下への参加を推奨する | ◆条件付きで推奨しない |
| ✓包括的な作業療法 | ✓電気療法 |
| ✓包括的な理学療法 | ✓カイロプラクティス |
注:アメリカでの推奨ですので実際の薬剤の使用に関しては日本の添付文章を参照してください。
ACRconvergence2022 13S161
6. さまざまな研究の発表
a. Cancer Screening in Inflammatory Myopathy(Abstract 0002)
デルファイ法を用いた22ヵ国75名のエキスパートによる推奨である。4つのパートから成り立っており、①リスクファクター、②スクリーニング方法、③スクリーニング頻度、④追加推奨である。
①リスクファクター
低リスク、中リスク、高リスクのリスクファクターが挙げられている。臨床表現系や抗体がリスクファクターとして取り上げられている(表4)。
表4 リスク因子
| 低リスク | 中リスク | 高リスク |
|---|---|---|
| 抗ARS症候群 | CADM | DM |
| 特発性筋炎のオーバーラップ症候群/CTD関連筋炎 | PM | 抗TIF1-γ抗体陽性 |
| 抗SRP抗体陽性 | IMNM | 抗NXP2抗体陽性 |
| 抗Jo-1抗体陽性 | 抗SAE抗体陽性 | 筋炎発症時40歳を超える |
| 非Jo-1ARS抗体陽性 | 抗HMGCR抗体陽性 | 免疫抑制療法にもかかわらず病勢が継続する |
| 筋炎関連抗体陽性(PM-Scl, Ku, RNP, Ro/La) | 抗Mi-2抗体陽性 | (中から高度の)嚥下障害 |
| レイノー | 抗MDA5抗体陽性 | 皮膚壊死 |
| 炎症性関節症 | 男性 | |
| 間質性肺炎 |
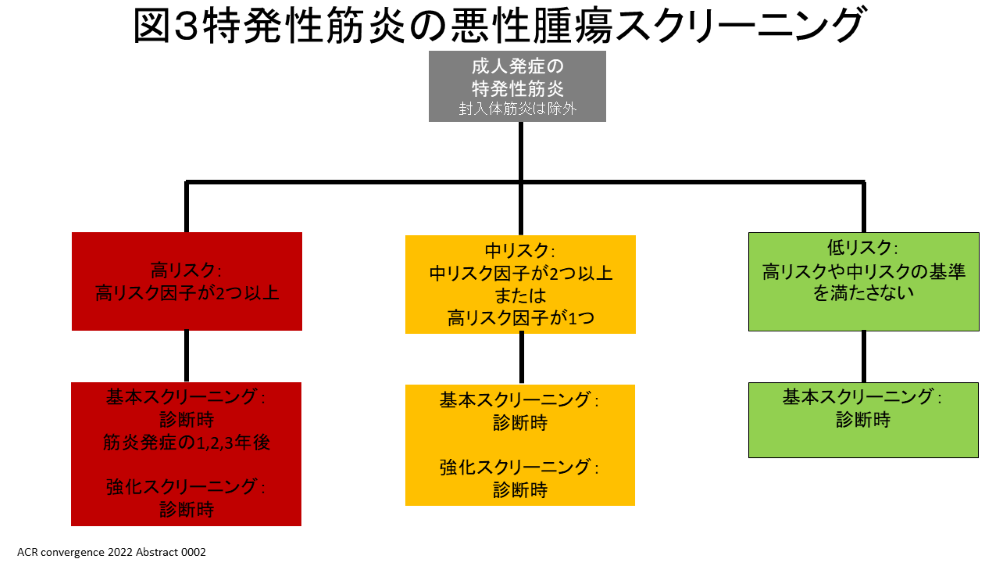
高リスクファクターが2つ以上あると高リスク、中リスクファクターが2つ以上あるいは高リスクファクターが1つある場合は中リスク、それ以外を低リスクと分類する。
②③スクリーニング方法並びにスクリーニング頻度
基本スクリーニングと強化スクリーニングの2種類があり(表5)、
表5 スクリーニング
| 基本スクリーニング (国や地域の年齢性別にあったスクリーニングに加えて) |
強化スクリーニング |
|---|---|
| ●包括的な病歴聴取 | ●CT (頚部、胸部、腹部、骨盤部) |
| ●包括的な身体診察 | ●子宮頸がんスクリーニング(例:塗抹試験など)* |
| ●血算 | ●マンモグラフィー* |
| ●肝機能検査 | ●PSA* |
| ●血沈 | ●CA-125 |
| ●CRP | ●卵巣癌の腹部/経膣超音波 |
| ●血清蛋白電気泳動 | ●便潜血* |
| ●尿検査 | *もし国や地域の年齢性別にあったスクリーニングになければ |
| ●単純X線 |
高リスク群では診断時並びに発症から1、2、3年目それぞれに基本スクリーニングを、また、強化スクリーニングを診断時に行うことが勧められている。中リスク群では診断時に基本スクリーニング並びに強化スクリーニングを、低リスク群では診断時に基本スクリーニングを行うことが勧められている(図3)。
④追加推奨
追加推奨としては、以下のような内容がある。
- ハイリスクの患者では診断時に癌がスクリーニングでみつからなかった場合には、上部下部内視鏡並びに18F-FDG-PETを考慮すべきである
- 抗TIF1-γ抗体陽性のDMで40歳以上発症かつ1つ以上の追加の抗リスクファクターがある場合には、18F-FDG-PETを唯一のスクリーニングとして考慮すべきである
- 鼻咽頭癌のリスクが上昇している地域では、成人の炎症性筋疾患診断時に鼻の内視鏡を行うことを考慮すべきである
b. Denosumab for OA(Abstract L05)
手のerosive OAは決定的な薬物療法を欠いているのが現況である。単施設の第2相二重盲検プラセボ比較試験にて手のerosive OAに対するデノスマブの効果が検証された。デノスマブは60mgを3ヵ月ごとに投与されている。主要評価項目は24週時点でのΔGUSSTM(Ghent University Scoring System)でΔがプラスであればリモデリング、マイナスであればびらんの進行となる。10の変化以上あれば臨床的に意義があるとされる。プラセボ群に比べてデノスマブ群は24週で+8.9、48週では+14.3であり両者とも統計学的に有意に差がついた。ペインスケールに関しては、24週、48週の時点では特に差がなかった。48週以降に両群ともにデノスマブに移行するオープンラベル延長に入るが、96週時点ではペインスケールがデノスマブ群では2.4、プラセボ群では3.5で有意に最初の48週デノスマブを投与した群で低くなっているのは興味深い。OAの構造的進展を防げる可能性のある薬剤の候補としてデノスマブが挙がることとなった。
c. 脊椎関節炎に対する生物学的製剤のコンビネーションによる治療 (abstract 1044)
脊椎関節炎はぶどう膜炎、乾癬、炎症性腸疾患など様々な領域の合併症をきたしうる疾患である。治療に際して、一つの領域は十分に抑えられているものの他の領域はうまく抑え切れていないという事象が起こることがある。生物学的製剤やJAK阻害剤などをコンビネーションで使用することは、その有害事象の心配から現在は標準的には行われないものであるが、今回、コンビネーションについて少数ではあるがまとまった報告があったので紹介する。29名のSpAの患者が含まれており、31のコンビネーション治療が行われた。29名のうち20名は炎症性腸疾患を合併していた。最も多かったコンビネーションはTNF阻害薬とIL-12/23阻害薬(54%)で、その次はTNF阻害薬とIL-17阻害薬(22.5%)であった。寛解や低疾患活動性は66.7%に見られ、薬剤を中止した人は12名(37.8%)であった。理由としては、7名で効果不十分、2名が有害事象、3名がその他の理由であった。重篤な有害事象は2名あり、非感染性び慢性肺浸潤影とブドウ球菌菌血症であった。治療抵抗性の患者に対しての、コンビネーション治療の更なる研究が行われる事で、治療抵抗性の患者に対する治療方法のさらなる発展が望まれる。
d. STOP RA試験(abstract 1604)
Great DebateのトピックでもあったPre-RAに関する研究である。抗CCP-3抗体が正常上限の2倍以上ある患者で過去やベースライン時に関節リウマチ様の関節腫脹が無い患者を対象に行われたランダム化二重盲検プラセボ比較試験である。実薬群はヒドロキシクロロキンを理想体重で6.5mg/kg/日以下の量で1年間投与され、その後2年間薬物なしで経過をフォローしていく試験デザインとなっている。中間解析で144名の参加者がおり、関節リウマチの発症はヒドロキシクロロキン群で34%、プラセボ群では36%であり有意差を認めなかった。有害事象や有害事象に伴う薬剤の中止率なども両群には大きな差はなかった。この中間解析の結果を受け、この臨床試験は中止となった。
e. ループス腎炎の寛解になるまでの時間や再燃の腎予後に与える影響(abstract 2061)
カナダのトロント大学のループスコホートを解析したデータである。5年位以上フォローアップされているループス腎炎のある患者を対象に行われた解析で、寛解は24時間尿で蛋白尿が0.5g/日未満、尿沈渣で活動性の兆候なし、そしてクレアチニン がベースラインの120%以下であると定義されている。少なくとも5年以上のフォローアップがなされているということで、実際に長期にフォローされたデータであることが特徴であるこのデータにおいて、ループス腎炎発症後20年までの生存曲線を示している、前向きコホート試験ならではのデータである。主要評価項目をCKDのstage4やstage5への悪化としている。当然のことながら、1年以内に寛解が得られた患者に比較すると1-3年で寛解が得られた患者(1年以内に寛解を得られた群と比較して、多変量解析で HR[ハザード比]2.48 [95%CI(信頼区間)1.14-5.37])、3年以上寛解が得られるまでにかかった患者(1年以内に寛解を得られた群と比較して、多変量解析で HR2.99 [95%CI:1.41-6.34])では主要評価項目へ至るリスクが高かった。また、再燃を起こさなかった群に比べて、1回の再燃(再燃のない群と比較して、多変量解析で HR2.68 [95%CI:1.05-6.86])、2回以上の再燃(再燃のない群と比較して、多変量解析で HR3.55 [95%CI:1.51-8.34])を起こす方が主要評価項目に至るリスクが高いことも示された。また、寛解をしてからの免疫抑制剤の使用の年数が3年未満と3年以上で3年以上の方が主要評価項目を満たすことが少なかったと示されている。
f. Pre-RAでの発症予測因子としての喀痰ないのCCP抗体 (abstract 0533)
抗CCP抗体陽性者では2-5年程度の間にそのうちの30%程度が関節リウマチを発症してくることが知られている。血清の抗CCP抗体が陽性者を対象とし、喀痰内の抗CCP抗体を測定し、関節リウマチの発症予測に寄与するかという研究が行われた。Derivationコホートでは、性別、リウマチ因子で調整した関節リウマチ発症のハザード比が3.4(95%信頼区間1.04-11.2)であった。Validationコホートではハザード比が5.4(95%信頼区間 1.2-23.1)であり、両コホートを合わせるとハザード比が4.2(95%信頼区間 1.7-10.4)となった。関節リウマチ発症のリスクの高い抗CCP抗体陽性者の中から、さらにリスクの高い患者を抽出する方法となり得る可能性がある。このコホートでは抗CCP抗体陽性のみであれば32%が関節リウマチを発症したが、喀痰内の抗CCP抗体も陽性である場合には67%が関節リウマチを発症した。大きなコホートでの結果の検証が重要となってくる。また、気道粘膜面以外の粘膜面の寄与に関しても検証が必要となってくる。
そのほかにも多くの興味深い発表があった。スペースの都合上、限られた情報のみの紹介となってしまったが、より良いリウマチ膠原病疾患の治療を実現するためにとても有益な学会であった。
文献
(1) Cheent K, et al.: J Crohns Colitis. 4(5): 603-605, 2010
