日本リウマチ財団ニュース
No.174号2022年9月号
国際学会報告
日本リウマチ財団ニュース174号に掲載しています「欧州リウマチ学会(EULAR)2022学会速報 」のロングバージョンです。
田巻 弘道 氏
聖路加国際病院 Immuno-Rheumatology Center 医長
責任編集:岡田 正人
医療情報委員会委員
聖路加国際病院 Immuno-Rheumatology Center
2020年、2021年とバーチャルで行われていたEULARであったが、75周年を迎えたEULAR2022はデンマーク・コペンハーゲンでの現地開催とバーチャルのハイブリッド形式となった。
今回のEULARの発表の中から、筆者が独断と偏見で興味深いと感じた内容をいくつかが取り上げる。
1.EULARの推奨
今回のEULARでは3つの重要なEULARの推奨が発表された。関節リウマチ(RA)、体軸性脊椎関節炎、そしてANCA関連血管炎である。
EULAR関節リウマチ推奨update 2022
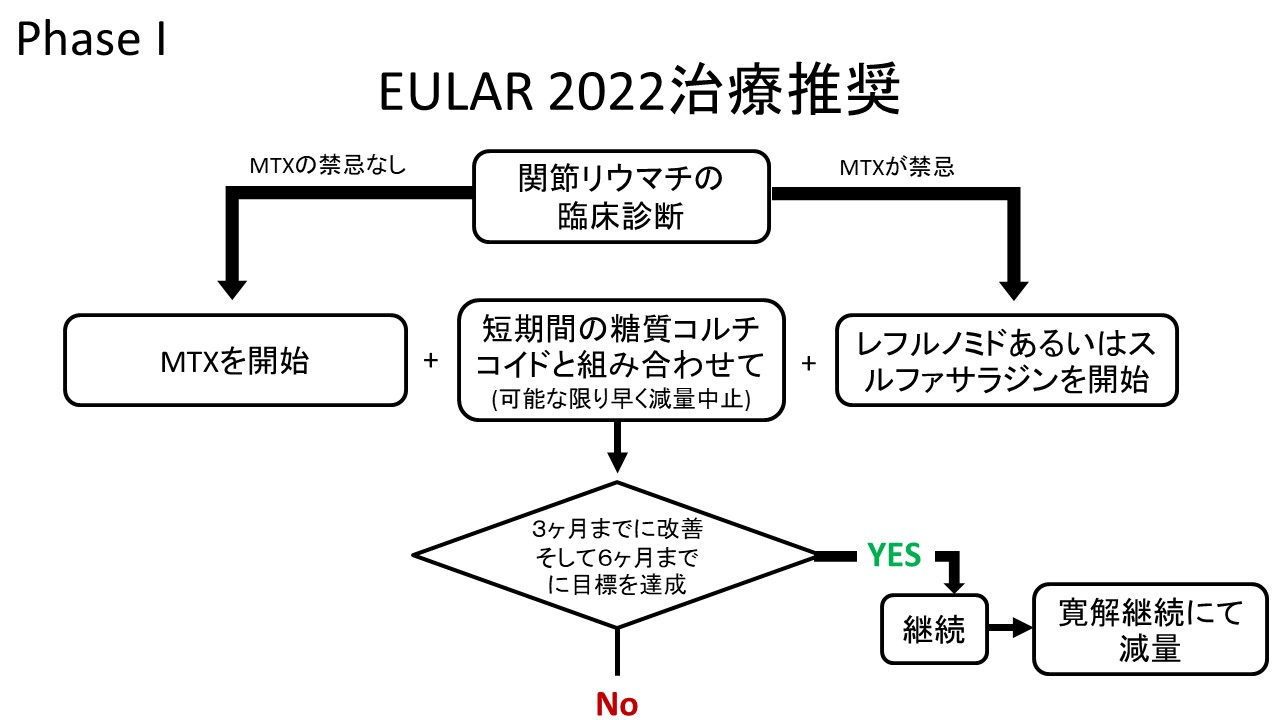
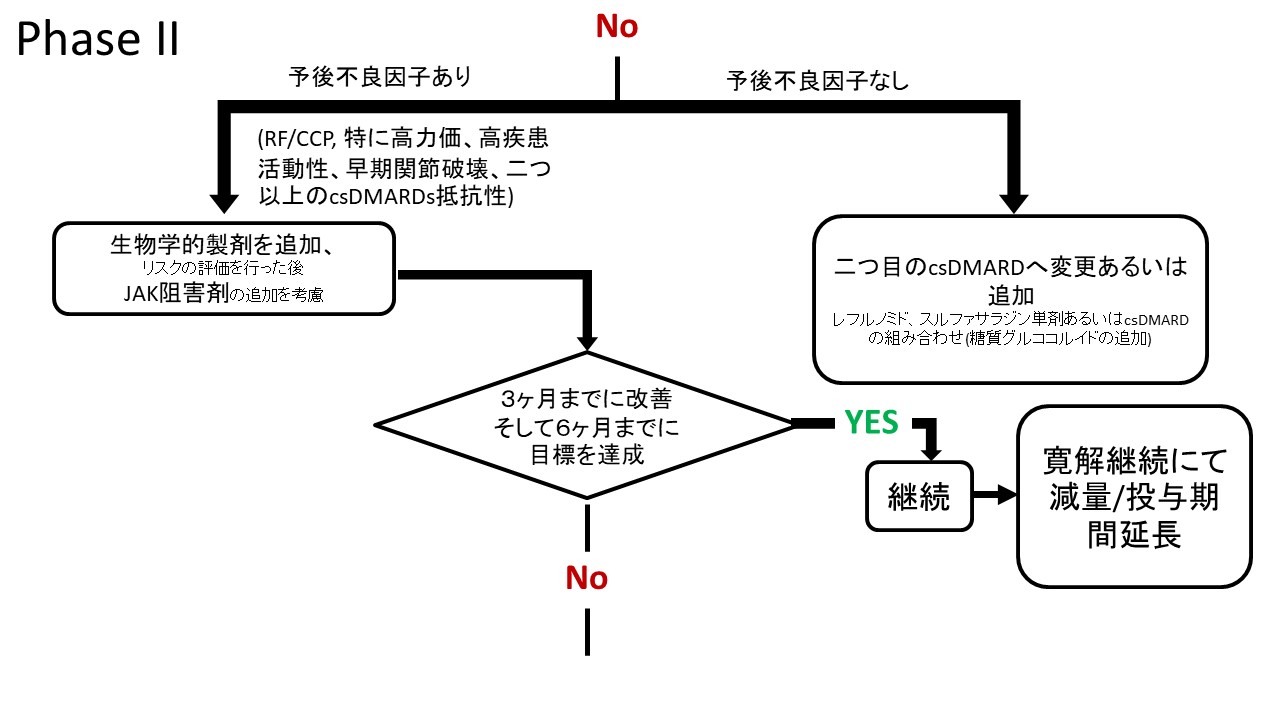
関節リウマチの推奨の最終のupdateは2019年であった。2009年のコペンハーゲンでのEULARでTreat to Targetの議論が深められ、2010年に最初のEULARの関節リウマチ治療推奨が出された。それ以来、2013年、2016年、2019年と改訂されてきたが、今回も最終版から3年の月日が流れ、改訂されるに至った。今回の推奨では前回から変更のあった点が4つある(表1)。
表1. EULAR RA recommendations update 2022 変更点
| Update 2019 | LoA | Update 2022 | LoA |
|---|---|---|---|
|
6. csDMARDsを開始あるいは変更する際に、さまざまな用量レジメンと投与経路の短期間の糖質コルチコイドを考慮すべきであるが、臨床的に可能な限り速く漸減すべきである。(A) |
8.9 ± 1.3 |
6. csDMARDsを開始あるいは変更する際に、さまざまな用量レジメンと投与経路の短期間の糖質コルチコイドを考慮すべきであるが、臨床的に可能な限り早く漸減中止すべきである.(A) |
9.3 ± 1.2 |
|
8. 予後不良因子があり、治療目標が最初のcsDMARDで達成できなかった場合、生物学的製剤や標的型合成抗リウマチ薬を加えるべきである(A) |
9.3 ± 1.0 |
8.予後不良因子があり、治療目標が最初のcsDMARDで達成できなかった場合、生物学的製剤を加えるべきである(A); JAK阻害薬は考慮しても良いが、関連のあるリスク因子を考慮に入れなければならない(A,B) |
9.1 ± 1.1 |
|
10. もし生物学的製剤や標的型合成抗リウマチ薬が効果がなかった場合、他の生物学的製剤や標的型合成抗リウマチ薬の治療を考慮すべきである。もしひとつのTNF阻害薬で効果がなかった場合、患者は他の作用機序の製剤、あるいは二つ目のTNF阻害薬で治療できる。 |
8.9 ± 1.2 |
10.もし生物学的製剤や標的型合成抗リウマチ薬が効果がなかった場合、他の生物学的製剤や標的型合成抗リウマチ薬の治療を考慮すべきである。もしひとつのTNF阻害薬やIL-6阻害薬で効果がなかった場合、患者は他の作用機序の製剤、あるいは二つ目のTNF阻害薬/IL-6阻害薬で治療できる |
9.3 ± 0.8 |
|
11.患者が継続的に寛解にあり、糖質コルチコイドを漸減したのちに、特に治療がcsDMARDとコンビネーション治療である場合、生物学的製剤や標的型合成型抗リウマチ薬の漸減を考慮可能である。(A) |
9.2 ± 1.0 |
11.糖質コルチコイド中止後、患者が継続的に寛解にある場合、DMARD(生物学的/標的型/従来型)の減量を考慮しても良い(A) |
9.3 ± 1.1 |
|
12.患者が継続的に寛解にある場合、csDMARDの減量も考慮できる。 |
9.0 ± 1.1 |
1つ目は、ステロイドの使用である。最新の米国リウマチ学会のガイドラインでは、関節リウマチに対するステロイド使用は短期間であっても推奨しないということになっているが、EULARは今回も短期間のステロイドの使用であればリスクよりもベネフィットのほうが勝るとの判断で、ステロイド短期間使用の考慮が推奨されることとなった。2019年の推奨では臨床的に可能な限り速やかに漸減すべきであると書かれていたのが、2022年の推奨では臨床的に可能な限り速やかに漸減中止すべきであるという文言へ変更となり、中止することがより強調されることとなった。
2つ目は、csDMARDs(従来型合成抗リウマチ薬)で治療目標が達成できなかった際の次の治療薬の推奨に関してである。ORAL Surveillance試験にて、トファシチニブの使用が一定のリスクのある患者に関して、心血管イベントや悪性腫瘍といった安全性評価の項目に対してTNF阻害薬と比較し、非劣性を示せなかった結果を受けての改訂である。2019年の推奨ではcsDMARDsで治療目標を達成できない予後不良因子をもったリウマチ患者には生物学的製剤あるいは標的型合成抗リウマチ薬が並列で推奨されていたが、2022年の改訂版では、これらの両者が併記されなくなり、生物学的製剤を加えるべきだという文の後に、JAK阻害薬も考慮できるかもしれないが、関連のあるリスク因子に関しては考慮に入れるべきだという文言が追加されることとなった。関連のあるリスクファクターとしては、65歳以上、現在あるいは過去の喫煙歴、その他の心血管リスク因子、その他の悪性腫瘍のリスク因子、血栓塞栓症のリスク因子が挙げられている。
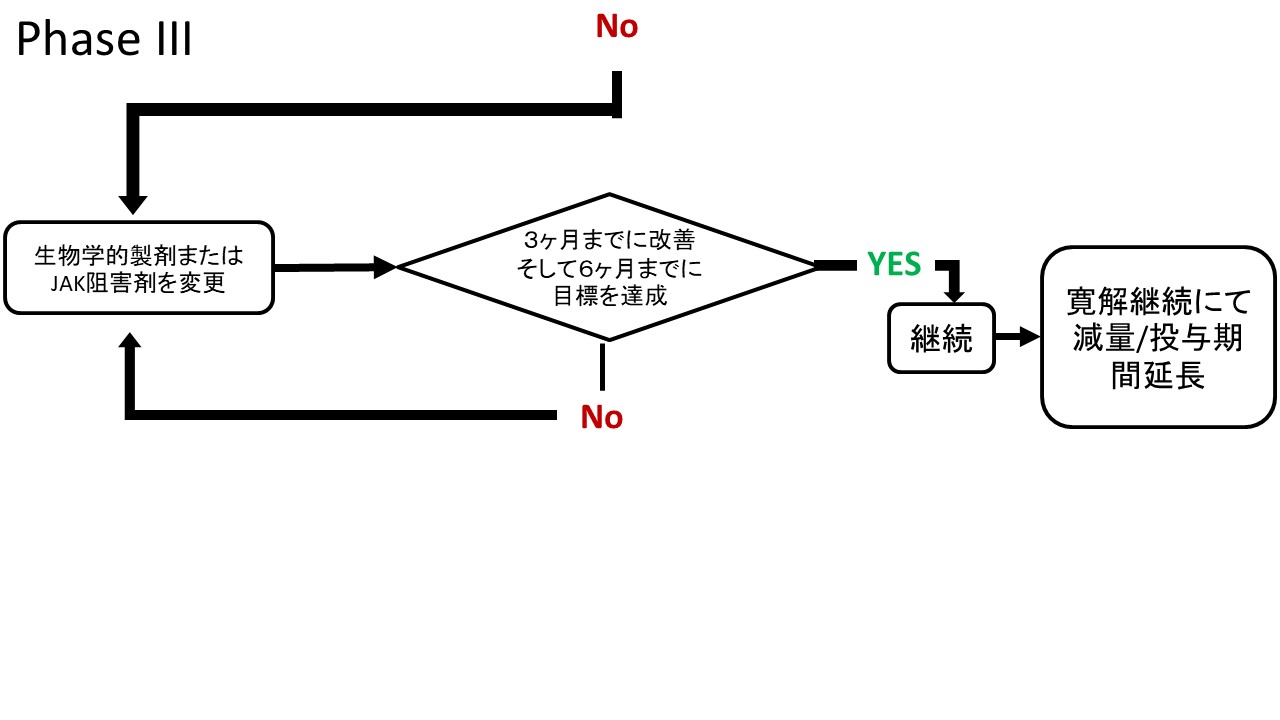
3つ目は、生物学的製剤や標的型合成抗リウマチ薬が効果不十分であった際、他の生物学的製剤や標的型合成抗リウマチ薬の使用を考慮すべきであるという推奨である。この推奨自体には変更はないが、2019年の推奨では1つのTNF阻害薬が不十分であったときは他の作用機序の薬剤あるいは2つ目のTNF阻害薬を考慮しても良いとなっていたところが、2022年の改訂では、1つのTNF阻害薬あるいはIL-6阻害薬が不十分であったときは他の作用機序の薬剤あるいは2つ目のTNF阻害薬あるいはIL-6阻害薬を考慮しても良いとIL-6阻害薬がTNF阻害薬と併記になった。同様の作用機序の生物学的製剤が複数ある際に、1剤が効果不十分となった後にはもう1剤違う種類であっても同じ作用機序の薬剤を使用する選択肢の中にIL-6阻害薬からIL-6阻害薬への変更が加わることとなった。JAK阻害薬に関してはまだ、同じJAK阻害薬の中での変更に関してはコメントがない。
4つ目は、DMARDsの減量に関して、である。2019年の推奨では、ステロイドの漸減の後、寛解が継続されている場合、特にcsDMARDが使用されている場合は、生物学的製剤や標的型合成抗リウマチ薬の漸減を考慮することができるという項目と、患者が継続的に寛解状態にある場合、csDMARDsの漸減が考慮できるという項目の2つが2022年の改訂では1項目にまとめられた。また、最初に述べられた変更点と記載を一致するために、ステロイドが中止され、寛解が維持されている場合にDMARDs(生物学的製剤、標的型合成抗リウマチ薬、csDMARDs)の減量を考慮しても良いという記載となった。ステロイドの中止が強調された今回の改訂に沿う内容に文言の変更があった。
全体の包括原則や、元々のTreat to Targetの推奨などには変更がなかったが、ステロイドに関する推奨の明確化、新たに出てきたデータを組み込んだ内容へと変化した。治療のアルゴリズムを図1に表示する。
EULAR ANCA関連血管炎推奨update2022
ANCA関連血管炎は多発血管炎性肉芽腫症(GPA), 顕微鏡的多発血管炎(MPA), 好酸球性多発血管炎性肉芽腫症(EGPA)の三つの疾患を含む。ANCA関連血管炎の推奨は2016年に発表されたものが最終となっている。2016年の推奨は15個からなっていた。今回の2022年のupdateにより、以前になかった包括原則が4つ新たに作られたのと17個の推奨から成り立っている。17個の推奨のうち6個は新たに作られた推奨文であり、8個は改訂されたものである。6年の間この領域におけるデータの蓄積が大幅に進んだことを示唆するものである。治療に関する部分はほぼ改訂あるいは新たな項目が作られており、また、前回の推奨ではEGPAが分けられていなかったものの、EGPAに特異的な治療薬の承認もあり、EGPAはGPA/MPAと分けて独立した項目が作られることとなった。全文は表2に掲載する。
表2 EULAR2022 ANCA関連血管炎の治療推奨
| ANCA関連血管炎EULAR治療:2022 Update NEW! REVISED! | Level of agreement (LOA) | Level of Evidence/Grade of Recommendations | |
|---|---|---|---|
| 包括的な原則A | ANCA関連血管炎における最良の医療のために、治療は効果や安全性や費用を考慮した上での患者ー医療者における共有意思決定に基づくべきである。 | ||
| 包括的な原則B | 患者は、ANCA関連血管炎の影響とその予後、主要な警告症状および治療(治療に関連する合併症も含む)に焦点を当てた教育を受ける必要がある。 | 9.8±0.6 | |
| 包括的な原則C | ANCA関連血管炎の患者は、治療に関連する副作用と併存疾患について定期的にスクリーニングする必要がある。治療に関連する合併症やその他の併存疾患を減らすために、予防とライフスタイルのアドバイスが推奨される。 | 9.6±0.5 | |
| 包括的な原則D | 稀で症状も多彩で、生命や臓器を脅かす可能性のあるANCA関連疾患は、多くの専門科が揃う医療施設で、血管炎の専門医と共にまたはすぐに連絡ができる状況下での治療が望まれる。 | 9.8±0.5 | |
| ANCA関連血管炎EULAR治療:2022 Update NEW! REVISED! | Level of agreement (LOA) | Level of Evidence/Grade of Recommendations | |
|---|---|---|---|
| #1:組織生検 | 生検結果の陽性は血管炎の診断を強く支持する。ANCA関連血管炎と診断するときやその再燃の有無を評価するときに生検を推奨する。 | 8.7±1.9 | 3b/C |
| #2:ANCA測定 | ANCA関連血管炎を疑う兆候や症状のある患者では、高品質の抗原特異的アッセイを使用したPR3-ANCAとMPO-ANCAの両方を最初の検査法として推奨する。 | 10.0±0 | 1a/A |
| #3:GPA/MPA寛解導入療法(Ⅰ) | 臓器障害や生命を脅かす新規または再発性のGPA/MPA患者での寛解導入療法では、糖質コルチコイドとリツキシマブまたはシクロホスファミドいずれかを組み合わせた治療を推奨する* 。 再発例ではリツキシマブが好まれる§。 ※CYCLOPS試験プロトコールによるIVCY投与量。 15mg / kg @ 0,2,4週,その後3週間ごと(腎臓/年齢調整が必要) |
9.6±0.8 | *1a/A,§2b/B |
| #4:GPA/MPA寛解導入療法 (Ⅱ) | 臓器障害や生命を脅かすことのないGPA/MPA患者での寛解導入療法では、糖質コルチコイドとリツキシマブの組み合わせによる治療が推奨される。メトトレキサートまたはミコフェノール酸モフェチルは、リツキシマブの替わりに考慮可能である。 | 9.2±0.8 | 1b/B |
| #5:糖質コルチコイド(GPA/MPA) | GPA / MPAの寛解導入療法のレジメンの一環として、体重に応じて、プレドニゾロンは50〜75mg/日の開始用量で経口糖質コルチコイドによる治療を推奨する。糖質コルチコイドは段階的に減らし(図)、4〜5か月でプレドニゾロン5mg/日を達成することを推奨する。 | 9.4±0.8 | 1b/A |
| #6:アバコパン | アバコパンは、リツキシマブまたはシクロホスファミドと組み合わせることで、糖質コルチコイドへの曝露を大幅に減らす戦略として、GPA/MPAの寛解導入療法にて考慮してもよい。 | 9.0±0.9 | 1b/B |
| #7:血漿交換 | 血漿交換は、活動性のある糸球体腎炎によって血清クレアチンが300μmol/L(3.39mg/dL)を超える患者のGPA/MPAにおける寛解導入療法の一部と見なすことができる*。 MPA /GPAの肺胞出血に対するルーチンでの血漿交換は勧められない§。 | *8.0±1.7,§8.8±1.3 | *1a/B,§1b/B |
| #8:難治性GPA/MPA | 寛解導入療に抵抗性を有するGPA/MPAの患者では、疾患の状態と併存疾患を徹底的に再評価し、追加または異なる治療の選択肢を検討することを推奨する。これらの患者では、血管炎の専門知識を備えたセンターと緊密に連携した管理または紹介が必要となる。 | 5/D | |
| #9: GPA/MPA維持療法 | GPA / MPAの維持療法は、リツキシマブまたはシクロホスファミドのいずれかによる寛解導入療後、リツキシマブで治療することを推奨する。アザチオプリンまたはメトトレキサートはその替わりとして考慮してもよい。 | 9.3±1.0 | 1b/A |
| #10:維持療法の治療期間 | 新規発症のGPA / MPAの維持療法は、寛解導入療法後24〜48か月間継続することを推奨する*。 再発例または再発のリスクが高い患者では、より長い維持療法の期間を考慮すべきであるが、患者の好みおよび長期的な免疫抑制治療によるリスクとのバランスを取るべきである§。 |
9.1±1.4 | * 1a/B,§ 4/D |
| #11: EGPA寛解導入療法 (Ⅰ) | 臓器障害または生命を脅かしうる新規発症または再発性のEGPAにおける寛解導入療法は、高用量の糖質コルチコイドとシクロホスファミドとの組み合わせによる治療を推奨する。高用量の糖質コルチコイドとリツキシマブの組み合わせを替わりに考慮してもよい。 | 9.6±0.8 | 2b/B |
| #12: EGPA寛解導入療法 (Ⅱ) | 臓器障害または生命を脅かすことのない新規発症または再発性のEGPAにおける寛解導入療法は、高用量の糖質コルチコイドによる治療を推奨する。 | 9.3±0.9 | 1b/B |
| #13: 再発性・難治性EGPA | 活動性の臓器障害または生命を脅かすことのない再発性または難治性のEGPAでは、メポリズマブの使用を推奨する。 | 8.9±1.3 | 1b/B |
| #14: EGPA維持療法 | 臓器障害または生命を脅かしうるEGPAにおける寛解導入療法後の維持療法では, メトトレキサート§, アザチオプリン&, メポリズマブ& またはリツキシマブ& の使用を考慮すべきである§。 再発時に臓器障害または生命を脅かしうる病態ではない再発例のEGPAの寛解後は、メポリズマブによる治療を推奨する*。 |
8.8±1.5 | §2b/D,& 4/-, * 1b/B |
| #15:バイオマーカー | ANCA関連血管炎の管理では、ANCAおよび/またはCD-19 + B細胞検査のみの評価というよりは、体系的な臨床評価も用いることで治療の変更の決定を行うことを推奨する。 | 9.3±1.1 | 1b/B |
| #16: 免疫グロブリン | リツキシマブを投与しているANCA関連血管炎の患者では、二次性の免疫不全を検出するために、各コースのリツキシマブ投与前に血清免疫グロブリン濃度を測定することを推奨する。 | 9.2±1.4 | 1b/B |
| #17: ニューモシスチス肺炎予防 | リツキシマブ、シクロフォスファミド、および/または高用量の糖質コルチコイドを投与されているAAVの患者には、ニューモシスチス・ジロベシイ肺炎およびその他の感染症の予防としてトリメトプリム-スルファメトキサゾールの併用を推奨する。 | 9.5±1.1 | 3b/B |
GPA/MPAの寛解導入に関して
ここでは主に3つのポイントについて取り上げる。
1つ目は、GPA/MPAの寛解導入療法で、重篤な症状がない場合にも糖質コルチコイドとリツキシマブが推奨された。リツキシマブの代替として日本では保健適用外である薬剤であるがメトトレキサートやミコフェノール酸モフェチルが記載されている。2021年のアメリカリウマチ学会(ACR)のガイドラインでは非重篤な場合には糖質コルチコイドにメトトレキサートを加えての治療が第一選択として勧められているのとは対照的である。リツキシマブの効果と安全性のバランスに関して評価されたことであると考えられる。
2つ目は、C5a受容体の阻害薬であるアバコパンも新たに寛解導入においての糖質コルチコイドを減らす戦略として用いられることが新たに記載された
3つ目は、血漿交換に関してである。重篤なGPA/MPAに対して血漿交換の使用が、死亡率と末期腎不全の複合アウトカムを減らすかという700名以上の患者が入ったPEXIVAS試験において、血漿交換の優位性が示せなかったという結果が2020年にNEJMに発表されたことを受けて、各国のガイドラインに変更がなされてきた。EULAR2022updateでは、『血漿交換は、活動性のある糸球体腎炎によって血清クレアチンが300μmol/L(3.39mg/dL)を超える患者のGPA/MPAにおける寛解導入療法の一部と見なすことができる。MPA /GPAの肺胞出血に対するルーチンでの血漿交換は勧められない。』と記載されることとなった。ACRの2021年のガイドラインでは、ルーチンで糸球体腎炎や肺胞出血には用いないことが推奨されているのとは対照的な推奨である。2016年のEULARの推奨ではMEPEX試験に基づいてクレアチニン 5.7mg/dl以上の患者の血漿交換が勧められていた。そして肺胞出血に関しても血漿交換が勧められていたところから、血漿交換を進める対象が広くなったのに対して、肺胞出血では勧めなくなったという変化である。糸球体腎炎に関しては、PEXIVAS試験を入れた新たなメタ解析がなされ、死亡率に関しては低下させないものの、1年後の末期腎不全は統計学的に有意に減らすことが示され、リスクとベネフィットを勘案したところこのような推奨に至ることとなったようである。
GPA/MPAの寛解維持
近年のリツキシマブの寛解維持のデータから、EULAR2022updateでもリツキシマブ が寛解維持の薬剤として第一に推奨されることとなった。これに関してはACRの2021年のガイドラインとも足並みが揃っており異論を挟む余地はない。ただ、維持療法時のリツキシマブの投与量に関してのコメントは現時点ではない。実際の推奨が発表された時にどのように記載されるのか興味のあるところである。
EGPAに関して
元々EULARの推奨ではEGPAが独立してあったわけではないので、今回のEGPAの推奨は全て新しくつくられたものとなる。重篤なEGPAでは寛解導入は糖質グルココルチコイドとシクロホスファミドの治療(シクロホスファミドの代替としてリツキシマブ)、非重篤なEGPAでは糖質グルココルチコイド単剤での治療が勧められており、非重篤な再燃ではメポリズマブが勧められている。重篤な症例での寛解後には、メトトレキサート、アザチオプリン、メポリズマブ、あるいはリツキシマブの使用が推奨されているが、日本でEGPAに保険適用のある薬剤はアザチオプリンとメポリズマブとなる。
最後に維持療法の期間であるが、2016年では寛解後に最低24ヵ月と述べられていたが、今回のupdateでは24から48ヵ月を考慮すると書かれることとなった。これらの期間を決めるにあたっては、患者の好み、長期的な免疫抑制剤のリスクも考慮した上で考えるべきとされている。
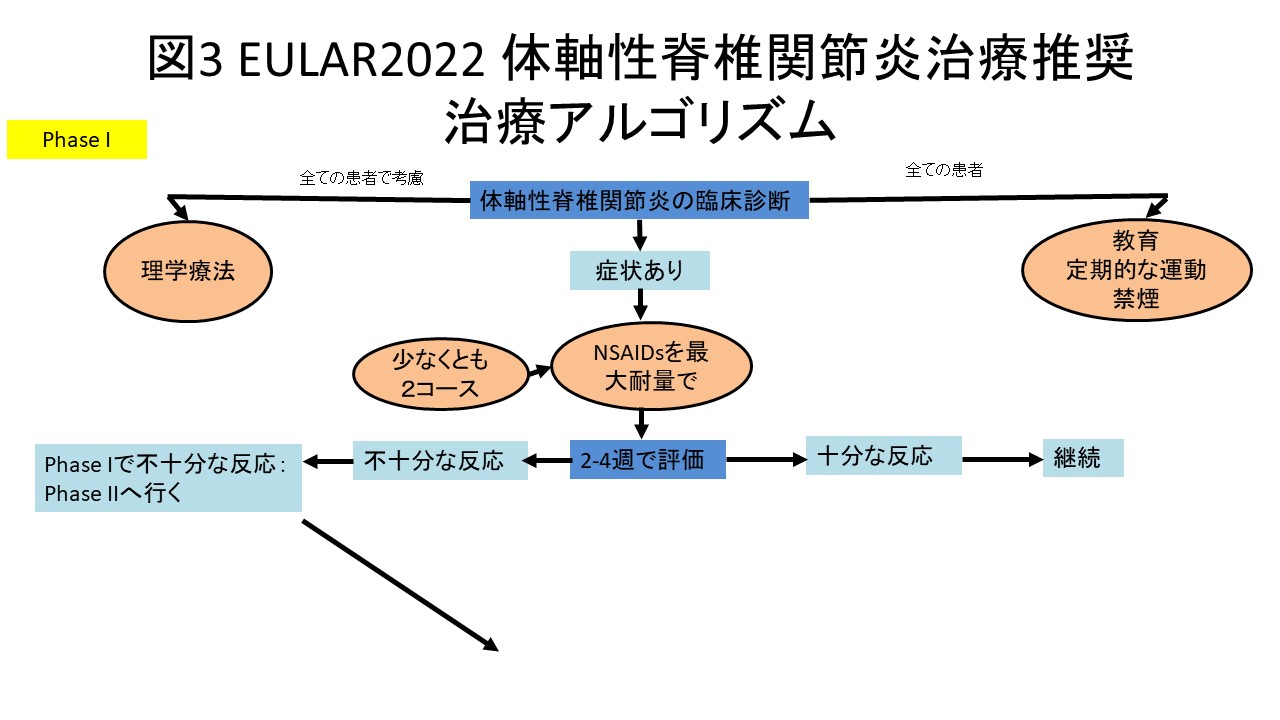
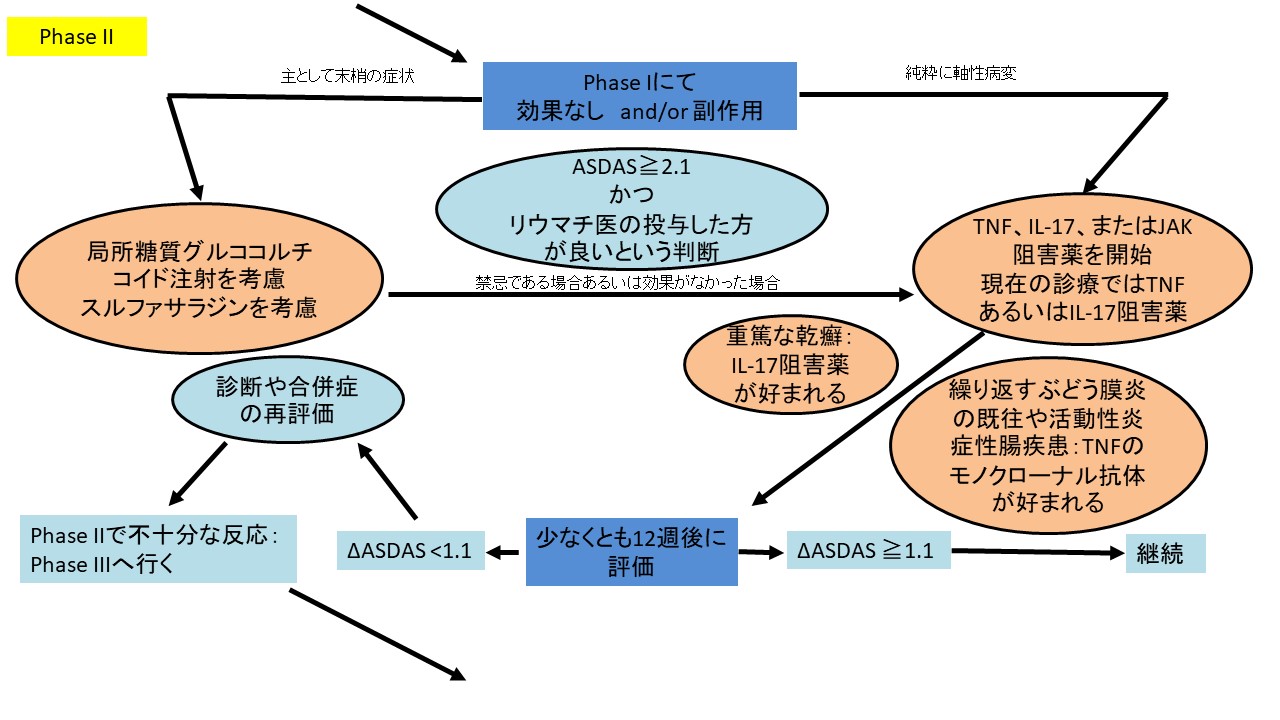
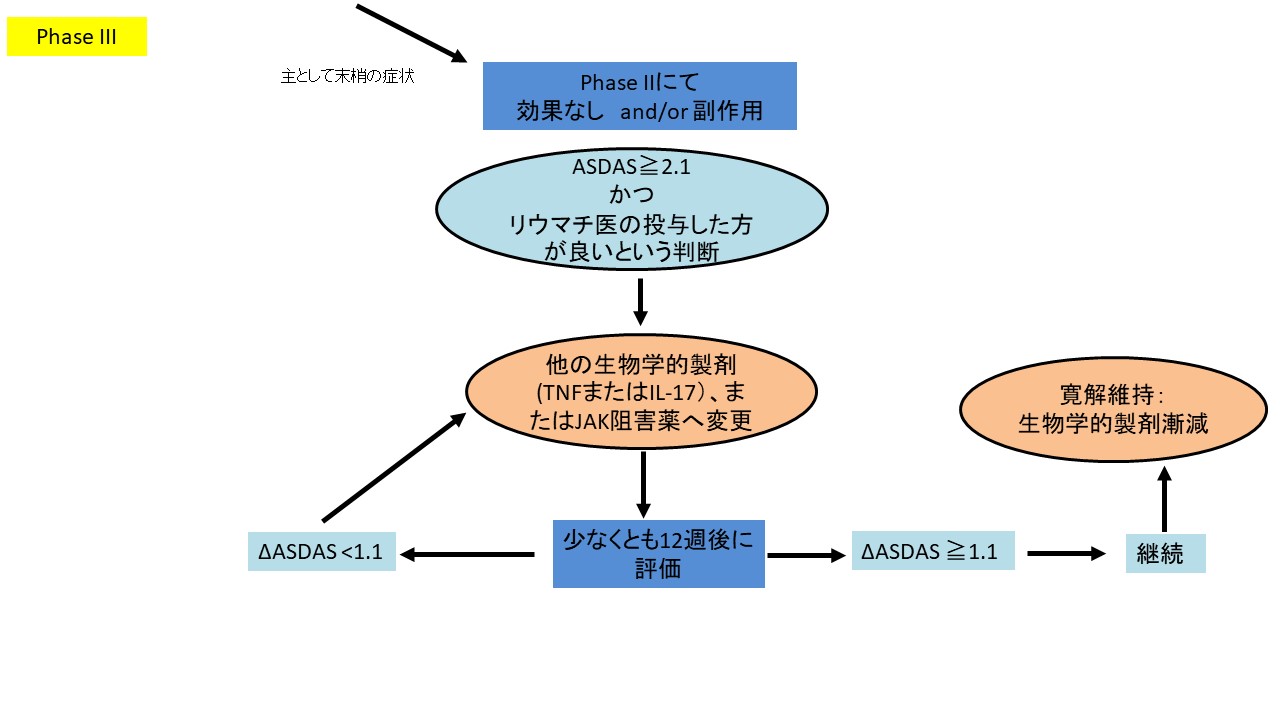
Axial SpAの推奨update2022
体軸性の脊椎関節炎の最終の推奨は2016年であった。今回の2022年updateでは、包括原則に関して変更はなかった。推奨本体に関しては、8つは変わらず、3つは命名法に関する小さな変更、2つの大幅な改訂ならびに2つの新しい追加の全部で15個の推奨文となっている。大きな変更となった二つの推奨は、治療の選択肢の増加に伴うものである(表3)。
表3 EULAR体軸性脊椎関節炎の推奨 2016年と2022年の新たな項目、大きな変更点
| 2016 | LoA | Update 2022 | LoA |
|---|---|---|---|
| 9.通常の治療でも高疾患活動性続く患者では生物学的製剤を考慮すべきである。現在の診療ではTNF阻害薬を始める。 | 9.6 | 9. 通常の治療でも高疾患活動性が続く患者ではTNF阻害薬、IL-17阻害薬、JAK阻害薬を考慮すべきである、現時点の診療ではTNF阻害薬またはIL-17阻害薬を始める。(IL-17阻害薬は ILー17A阻害薬のことのみを指す) | 9.2 |
| なし | 10.繰り返すぶどう膜炎や活動性のある炎症性腸疾患のある患者の場合は、モノクローナルのTNF阻害薬(ベグ化されたFab製剤も含む)が優先されるべき である。重篤な乾癬がある場合にはIL-17阻害薬が好まれる。 (IL-17阻害薬は ILー17A阻害薬のことのみを指す) | 9.1 | |
| なし | 11.治療反応性が悪い場合に関してである。治療反応がない場合は、診断の再評価並びに合併症の存在を考慮すべきである。 | 9.5 | |
| 10. TNF阻害薬が効果がないときには、他のTNF阻害薬かIL-17阻害薬への変更を考慮すべきである。 | 9.6 | 12. 最初の生物学的製剤や標的型抗リウマチ薬が効かなかった際には、生物学的製剤(TNF阻害薬やIL-17阻害薬)あるいはJAK阻害薬を考慮すべき (IL-17阻害薬は ILー17A阻害薬のことのみを指す) | 9.3 |
1つ目の大きな変更は従来の治療をしていても高い疾患活動性が継続する患者に対する治療である。元々、TNF阻害薬並びにIL-17阻害薬が推奨されていたが、そこに今回JAK阻害薬も追加されることとなった。また、2016年時点で、現時点ではTNF阻害薬が開始されることが通常であるという記載になっていたのが、今回は、TNF阻害薬あるいはIL-17阻害薬が開始されるのが現在の通常であるとの記載に変更になっており、この6年間でIL-17阻害薬の体軸性脊椎関節炎への使用経験が増えたことが反映されている。ちなみに、今回の推奨文ではIL-17阻害薬に関しては、IL-17A阻害薬のみを指すと但し書きが追加されている。また、生物学的製剤またはJAK阻害薬を開始する基準に関しては、以前は疾患活動性に指標として、BASDAIが4以上、ASDASが2.1以上と2つの指標が併記されていたが、今回の推奨のupdateではASDASのみと変更された。
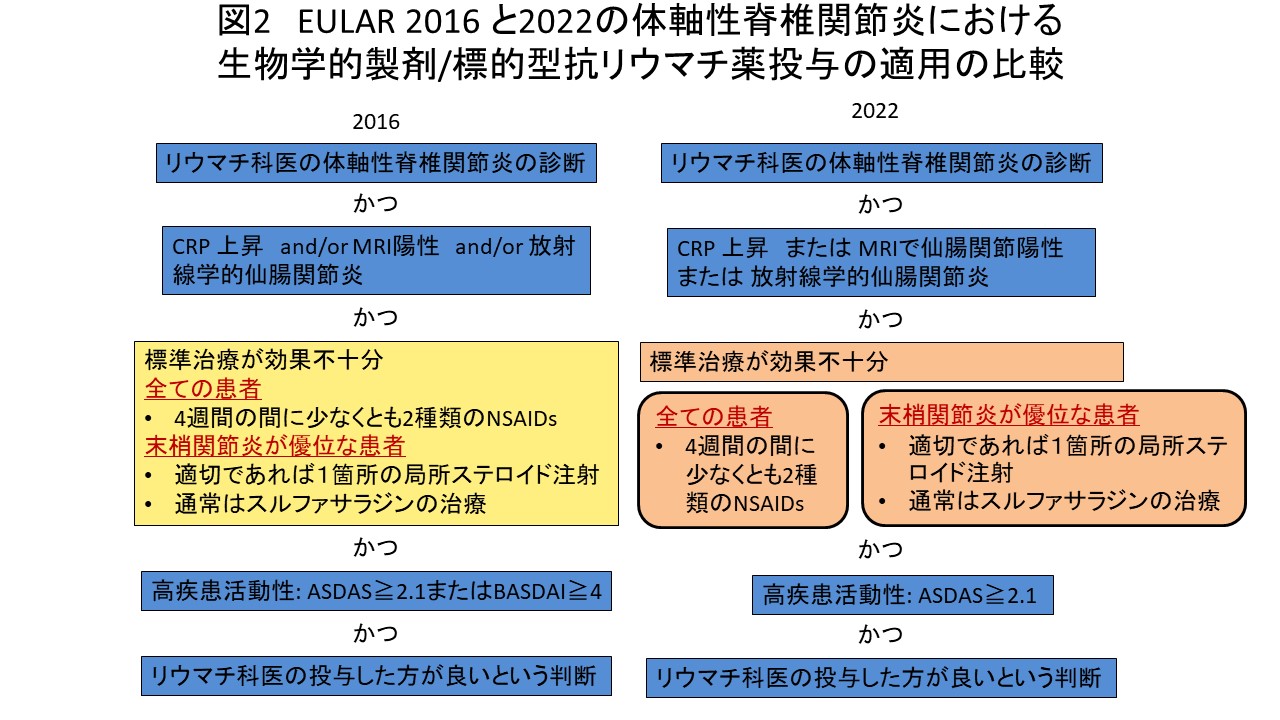
2つ目の大きな変更は、生物学的製剤の治療が効かなかった際の推奨文である。2016年の推奨ではTNF阻害薬で効果がなかった場合には、異なるTNF阻害薬あるいはIL-17阻害薬を考慮すべきであるという記載となっていた。現在、治療選択肢の増加に伴い以下のように変更された。最初の生物学的製剤や標的型抗リウマチ薬が効かなかった際には、生物学的製剤(TNF阻害薬やIL-17阻害薬)あるいはJAK阻害薬を考慮すべきであるとなっている。
新しく加わった2つの項目に関しても述べていく。
新しく加わった項目の1つ目は、筋骨格系以外の症状がある患者に関して、である。繰り返すぶどう膜炎や活動性のある炎症性腸疾患のある患者の場合は、モノクローナルのTNF阻害薬(ベグ化されたFab製剤も含む)が優先されるべきと記載され、重篤な乾癬がある場合にはIL-17阻害薬を考慮しても良いかもしれないという旨が記載されている。脊椎関節炎によく並存する疾患に関して患者全体像を考慮に入れた上で治療選択肢を考慮していくことが書かれている。
2つ目の新たな項目は、治療反応性が悪い場合に関して、である。治療反応がない場合は、診断の再評価並びに合併症の存在を考慮すべきであるという推奨文が新たに追加された。並存疾患とは、線維筋痛症や変形性関節症のことである。痛みがすなわち炎症とイコールではなく、非炎症性の痛みに対しては生物学的製剤や標的型抗リウマチ薬による治療のエスカレーションでは利益は認められないことは当然である。通常効くはずの薬物療法に効果がない際には立ち止まって診断や合併症を考え直すというリウマチ膠原病診療における基本に関して述べられた項目となっている。全体的な治療アルゴリズムを図3に示す。
個人的に興味を惹かれた発表や研究結果
Oral Presentation
OP0170
第IIa相 炭酸水素ナトリウムの経皮投与の痛風発作に対する効果を検証したランダム化二重盲検プラセボコントロール試験
痛風発作の際に、経皮的に投与した炭酸水素ナトリウムは、理論的には関節中のアルカリ化を促進し、尿酸結晶の溶解を促進、痛みを減らす可能性がある。経皮的投与された炭酸水素ナトリウムの効果を検証したランダム化二重盲検プラセボコントロール試験が発表されていた。被験者は痛風発作の際にコルヒチンを内服するとともに、プラセボまたは炭酸水素ナトリウムの経皮投与をされ、0-10の痛みスケール、痛みの改善期間(痛みスケールが50%減少する期間)、レスキュー薬、圧痛関節、身体機能(PROMIS PF-20)などが指標とされた。98名が痛風発作を起こし、7日間の観察では、95.4%が実薬群で、79.3%がプラセボ群で反応あり(P=0.01)と実薬群で有意な効果を認め、レスキュー薬の使用も、実薬群では6.3%、プラセボ群では20%(P=0.03)と差を認めた。痛みの改善期間の中央値も、実薬群では24時間、プラセボ群では72時間と差を認めた(p=0.03)。安全性に関しては実薬とプラセボで大きな差はなかった。
痛風は様々な合併症を持つ患者に多く、この薬剤は経皮的な投与であり、様々な理由で急性発作時の薬物療法が難しい患者さんに対して福音になる可能性がある。
OP0255
Bimekizumabの乾癬性関節炎に対する効果を検証した第Ⅲ相ランダム化二重盲検プラセボ比較試験(BE COMPLETE)
BimekizumabはIL-17A並びにIL-17Fを抑えるモノクローナル抗体である。この試験では活動性の乾癬性関節炎で、TNF阻害薬が効果不十分であった患者を対象にBimekizumabの効果をプラセボと比較した試験である。主要評価項目は16週時点でのACR50を達成した患者の割合である。全部で400名の患者が2:1でBimekizumabとプラセボに割り付けられた。4週目からACR50の差が見られ、16週時点ではBimekizumab群で43.3%、プラセボ群で6.8%がACR50を達成しており、Bimekizumab群が有意にACR50の達成割合が高かった。PASI100の達成はBimekizumab群で58.5%、ACR70達成割合はBimekizumab群で26.6%といづれもプラセボ群よりも有意に高かった。特に、新たに出てきた安全性の問題は認めなかった。
現在、日本では既存治療で効果不十分な尋常性乾癬、膿疱性乾癬、乾癬性紅皮症に適用があるが、今後乾癬性関節炎に対しても使用可能になるかもしれない。
OP0279
治療抵抗性のSLEに対するCAR-T療法
CAR-T療法とは、白血病、リンパ腫、多発性骨髄腫などの血液悪性疾患で一定の条件を満たした再発性や治療抵抗性の患者に使用される治療法である。患者さんのT細胞に対して遺伝子操作によってchimeric antigen receptor(CAR)と呼ばれる腫瘍細胞の抗原を認識する受容体を発現させ、そのT細胞を患者さんに戻すという免疫療法の一種である
2021年にSLEに対するCAR-T療法の症例報告がNew England Journal of Medicineに発表された(N Engl J Med 2021; 385:567-569)。EULARでは4例の通常の薬物治療に対して治療抵抗性の腎炎を持つSLEにCD19 CAR-T細胞による治療の結果が報告された。全員がLLDAS(lupus low disease activity)が達成でき、全員がSLE治療薬を辞めることができたと報告されている。今後重篤なSLEに対する治療経験が蓄積されていくことが望まれる。
Late Breaking Abstract 0004
Deucravacitinibの全身性エリテマトーデスに対する効果を検証した第Ⅱ相ランダム化二重盲検プラセボ比較試験
Deucravacitinibは、TYK2阻害薬である。TYK2はI型インターフェロンやIL-6, IL-10, IL12, IL23などのサイトカイン受容体と関わりがある。また、高IgE症候群の一部はTYK2遺伝子の変異に伴う疾患である。TYK2欠損による高IgE症候群は常染色体劣性遺伝であり、抗酸菌感染症や重症ウィルス感染症を繰り返す原発性免疫不全症である。
今回発表された試験は、SLEDAI≧6かつ≧1 BILAG index Aまたは≧2 BILAG index Bで少なくとも1項目は筋骨格あるいは粘膜皮膚からきている患者を対象に行われ、プラセボ、Decravacitinib3mg1日2回、6mg1日2回、12mg1日1回の4群に割り付けられた。主要評価項目は32週でSRI4を満たした患者の割合であった。SRI4を達成した患者の割合は、プラセボ群で34.4%、Decravacitinib3mg1日2回群で58.2%(P=0.0006)、6mg1日2回群で49.5%(P=0.021)、12mg1日1回群で44.9%(P=0.078)であった。有害事象に関しても、それぞれの群で大きく変わることはなかった。今後、DecravacitinibはSLEに対する第Ⅲ相試験へ進むこととなっている。
Late Breaking Abstract 0006
サリルマブのリウマチ性多発筋痛症への効果
リウマチ性多発筋痛症は、エビデンスのある治療法の確立が遅れている分野である。今回、IL-6阻害薬であるサリルマブをリウマチ性多発筋痛症に使用した第Ⅲ相多施設共同二重盲検ランダム化プラセボ比較試験の結果が発表された。プレドニゾン7.5mg以上内服中に再燃を起こしたリウマチ性多発筋痛症患者に対して1:1でサリルマブ200mgを2週間ごとに投与と14週かけてのステロイドの漸減を行う群と、プラセボとステロイドを52週かけて漸減する群との2群を比較する試験で、主要評価項目は52週時点で寛解維持ができていることである。COVID-19のパンデミックに伴い、患者リクルートが長引き、早期で中断となってしまったが、280名を予定していたところ118名がランダム化された。52週での寛解維持はサリルマブ群で28.3%、プラセボ群で10.3%であり統計学的に有意に差を認めた。ステロイドの使用量も、有意にサリルマブ群で少なかった。安全性においても既知の情報と合致するものであった。リウマチ性多発筋痛症において、ステロイド使用量を減らすことのできる有力な薬剤として期待がもてる結果であった。
ポスター(POS0531)
関節リウマチの発症リスクの高い患者に対するアバタセプトによる介入
関節リウマチ発症のリスクの高い患者群(Anti-Citrullinated Peptide Antibody(ACPA)陽性かつ関節痛がある/あったかつ利き手のMRIで滑膜炎/骨炎の所見があるものの、以前/現在に関節の腫脹がない)かつステロイドや抗リウマチ薬の投薬を受けていない患者に対して6ヵ月間アバタセプトを投与あるいはプラセボを投与する2群に分け、薬剤投与後12ヵ月間観察した試験である。6ヵ月までの段階の結果がアメリカリウマチ学会で発表されていたことは記憶されている方も多いかと思う。主要評価項目である6ヵ月の時点でのRAMRIS scoreを用いたMRIの炎症のパラメーター(滑膜炎、腱鞘滑膜炎、骨炎)の改善と決められている。主要評価項目を満たしたのはアバタセプト群で61.2%、プラセボ群で30.6%(p=0.0043)であった。6ヵ月時点で関節炎に移行したのはアバタセプト群で8.2%、プラセボ群で34.7%(p=0.0025)であった。12ヵ月の無投薬の期間ののちも関節炎に移行したのはアバタセプト群で35%、プラセボ群で47%(p=0.0421)であり、アバタセプトに発症予防効果がある可能性が示唆された。
ポスター(POS0881)
ブロダルマブの全身性強皮症に対する効果
中等度から重度の皮膚硬化のある全身性強皮症患者に対して、ブロダルマブを用いた第Ⅲ相のランダム化二重盲検プラセボ比較試験の結果が日本から報告されていたので紹介する。レイノー以外の症状が出現してから60ヵ月以内で、modified Rodnan Skin Score(mRSS)が10以上30未満かつ以下のうちの1つの基準を満たす(diffuse cutaneous systemic sclerosisが新規に1年以内に診断、mRSSが2~6ヵ月前の診察に比べて3以上上昇、2以上の上昇かつ1つの新規病変、1以上の上昇かつ2つの新規病変)患者が組み込まれた。主要評価項目は、24週でのmRSSの変化量である。ブロダルマブ群、プラセボ群ともに50名ずつランダム化され、24週時のmRSSの変化量はブロダルマブ群で-16.8、プラセボ群で+4.4であり統計学的有意差をもってブロダルマブ群のほうがmRSSの改善がみられた。治療の選択肢に限りがあった全身性強皮症であるが、患者さんの予後改善がさらに進んでいくことを確信した報告であった。
以上限られたスペースの中での報告となったが、日々の臨床に役立つ情報が満載されていた会議であった。様々な関係者の方にいろいろな情報をいただき完成した
