日本リウマチ財団ニュース
No.193号2025年11月号
国際学会報告書 欧州リウマチチ学会(EULAR)2025
日本リウマチ財団ニュース193号に掲載しています「欧州リウマチ学会(EULAR)2025学会速報 」のロングバージョンです。
田巻 弘道
聖路加国際病院 Immuno-Rheumatology Center医長
責任編集:岡田 正人
医療情報委員会委員
聖路加国際病院 Immuno-Rheumatology Center
はじめに
EULAR2025はスペインのバルセロナで行われた。今回も非常に盛り上がった学会であったが、今回のEULARの発表の中から、筆者が独断と偏見で興味深いと感じた内容を幾つが取り上げる。
1.EULARの推奨
毎年恒例のEULAR推奨のセッションであるが、今回もIとIIの二つのセッションがあった。近年、盛りだくさんで行われるEULAR推奨のセッションである。それぞれのセッションで紹介されていたものは以下のとおりである。
Session I
EULAR/ERS diagnostic and therapeutic approach of interstitial lung disease in connective tissue disease
Update of the 2018 EULAR recommendations for physical activity in people with inflammatory arthritis and osteoarthritis
Development and validation of a EULAR disease activity score in Antiphospholipid syndrome
Update of the EULAR recommendations for patient education in people with inflammatory arthritis including recommendations for implementation into clinical practice
2023 EULAR recommendations for the management of SLE with kidney involvement
Session II
Recommendation for the management of Familial Mediterranean Fever
EULAR-ACR Classification Criteria for Antisynthetase Syndrome (CLASS)
EULAR Point to Consider for the Definition of Difficult to Treat Psoriatic Arthritis (D2T PsA)
EULAR Classification Criteria for haemochromatosis arthropathy
EULAR recommendations for the Management of Rheumatoid Arthritis: 2025 Update
その他にも、ベーチェット病のセッションで、ベーチェット病のマネージメントの推奨のupdateも発表されていた。
この中からいくつか取り上げる。
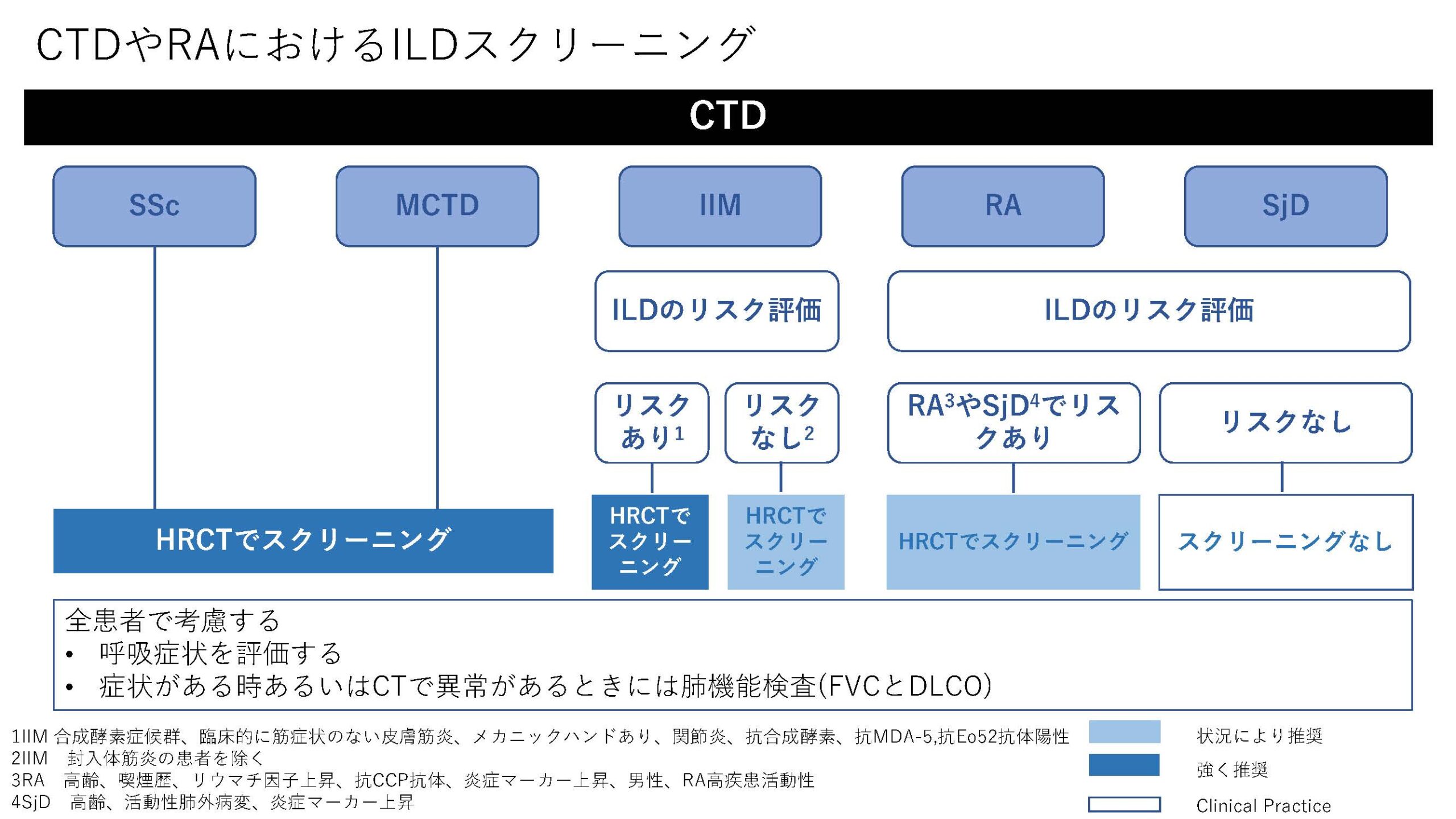
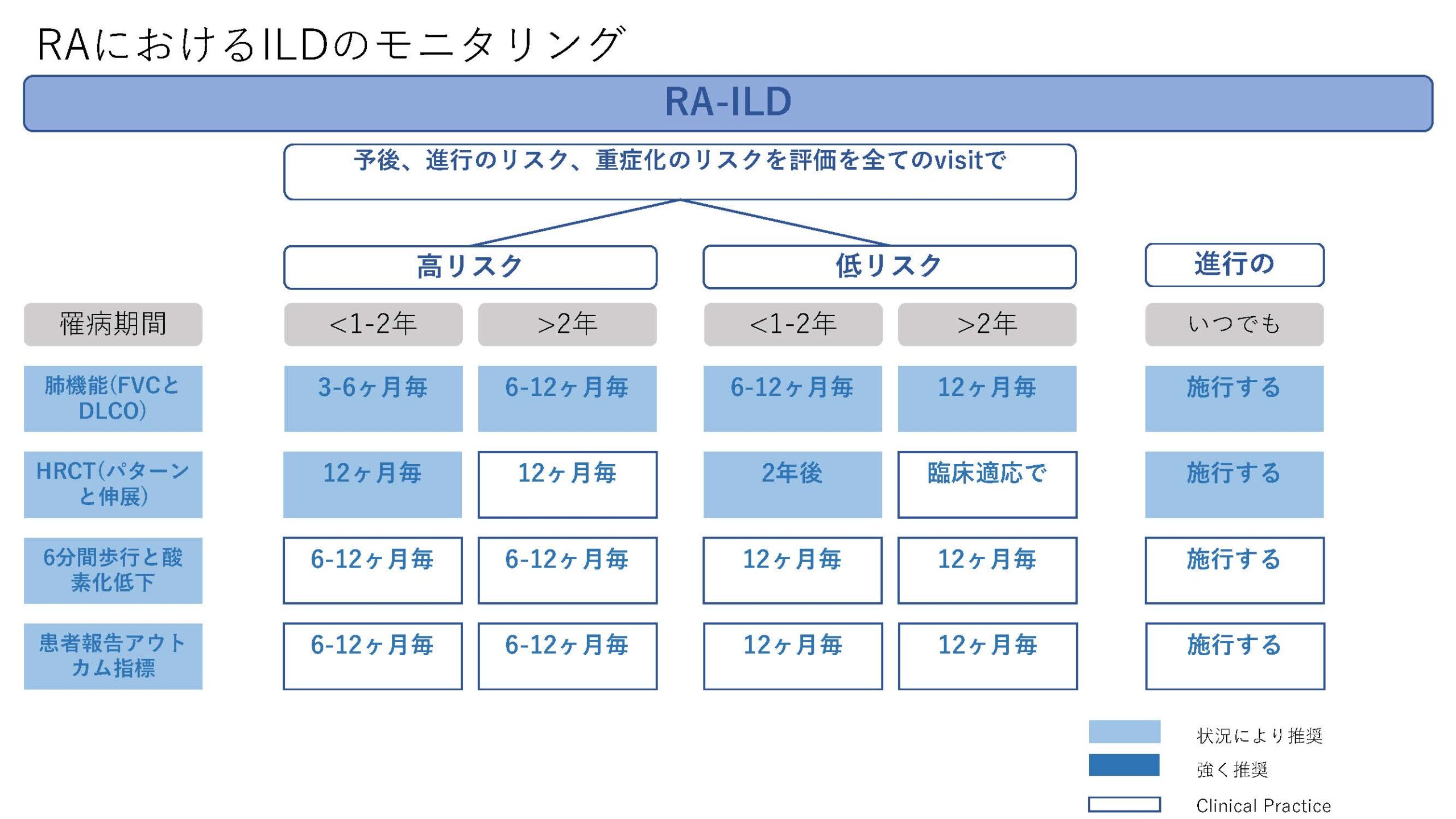
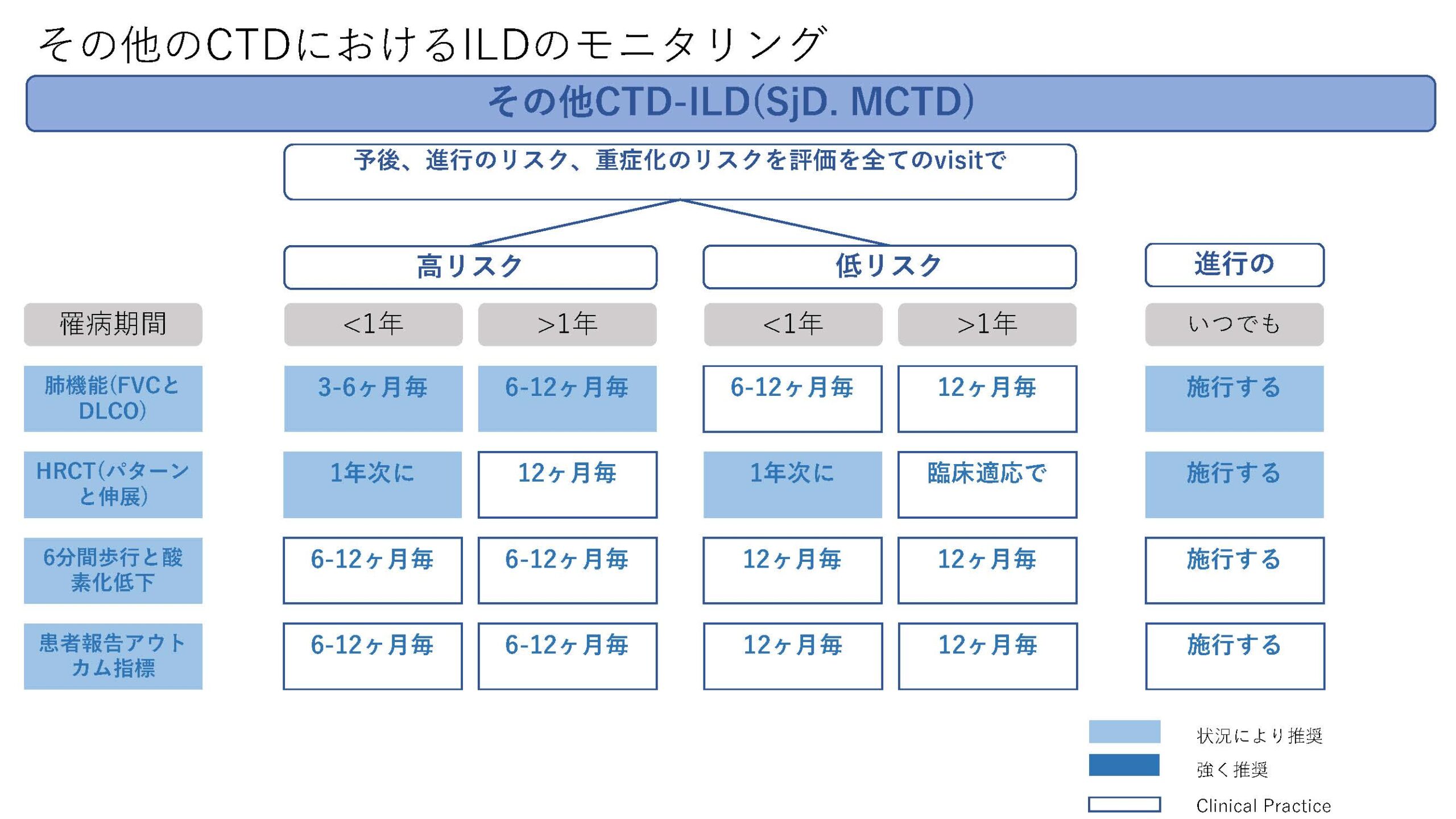
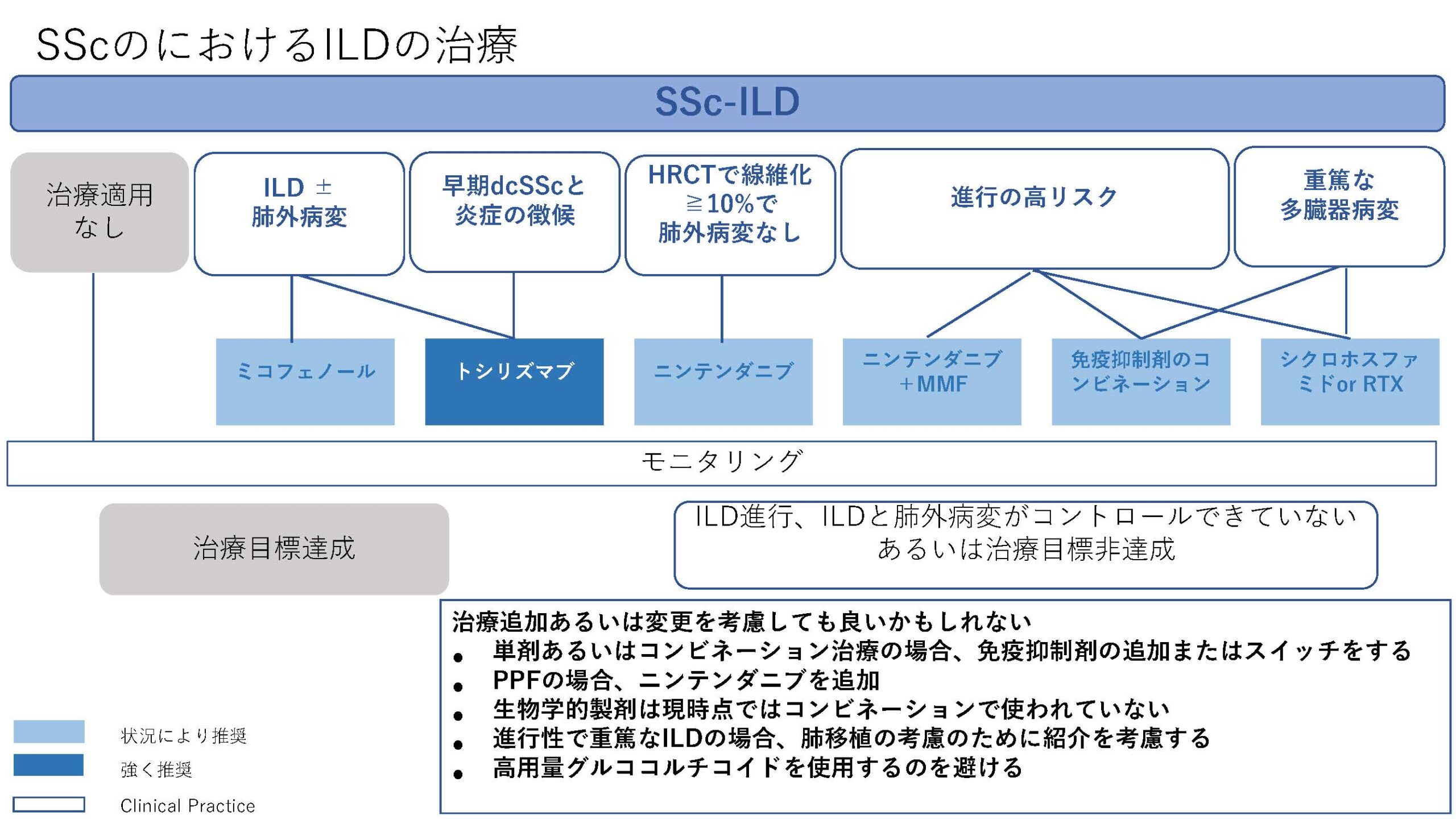
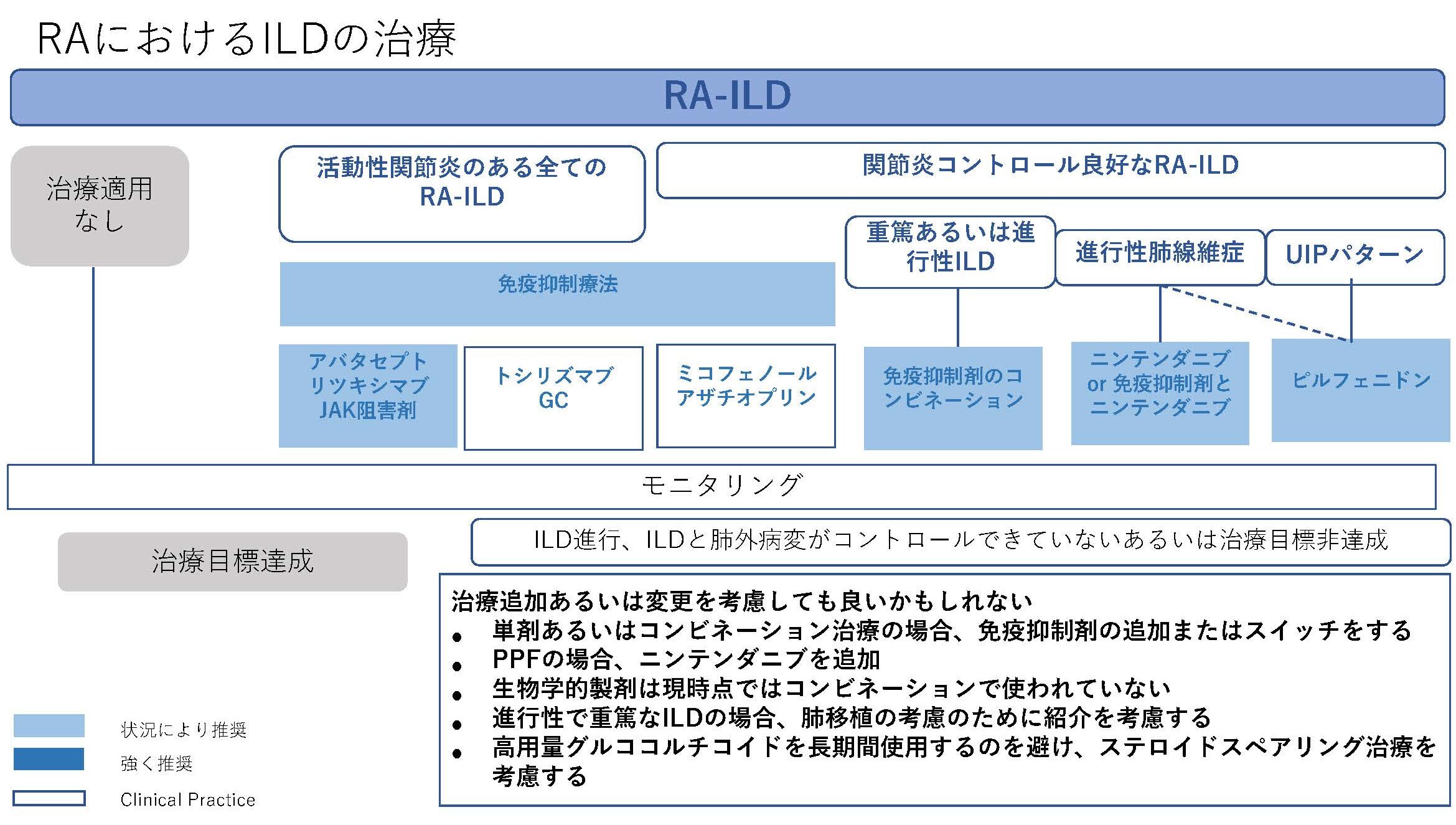
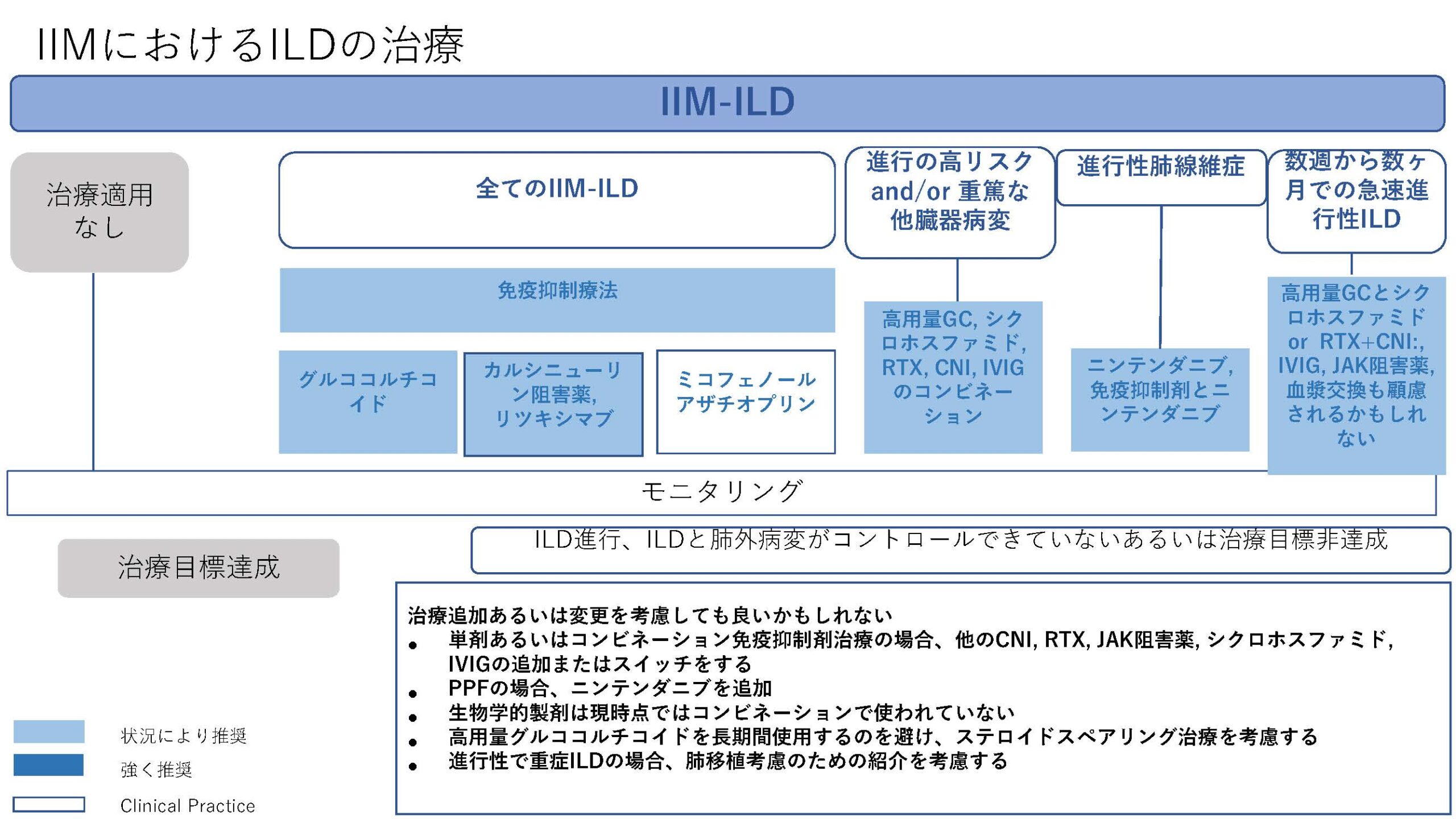
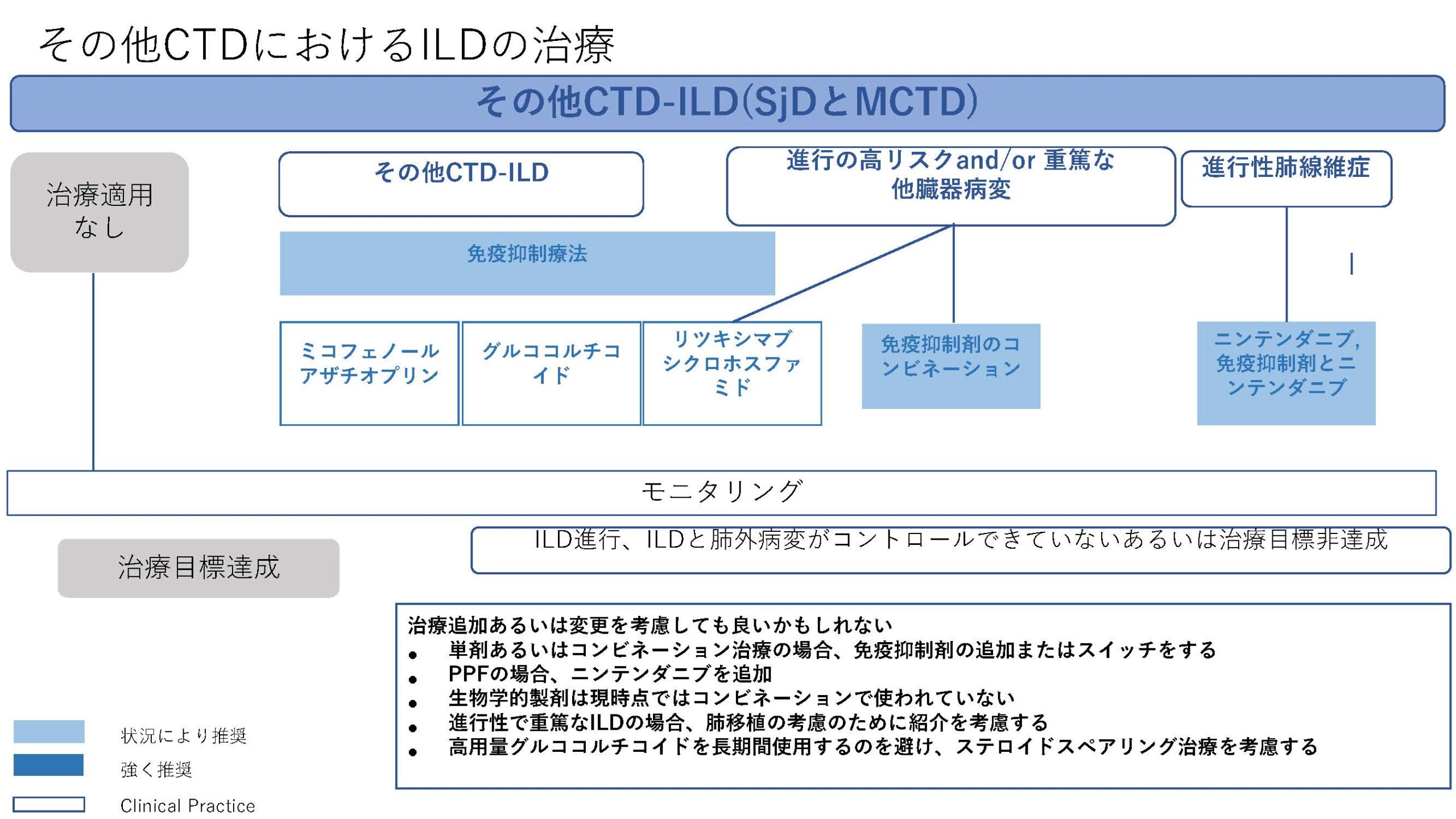
★EULAR/ERS diagnostic and therapeutic approach of interstitial lung disease in connective tissue disease(表1)
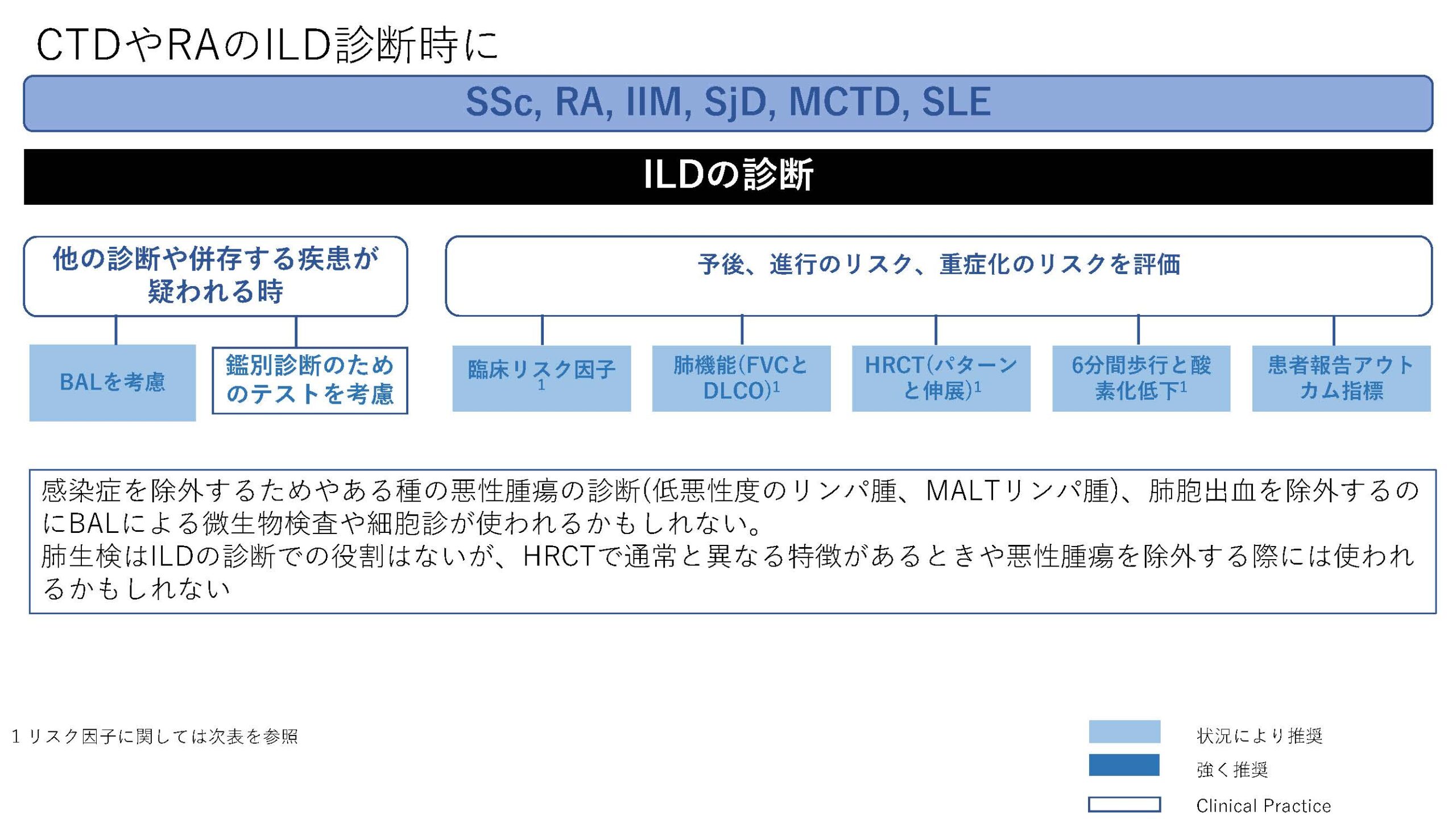
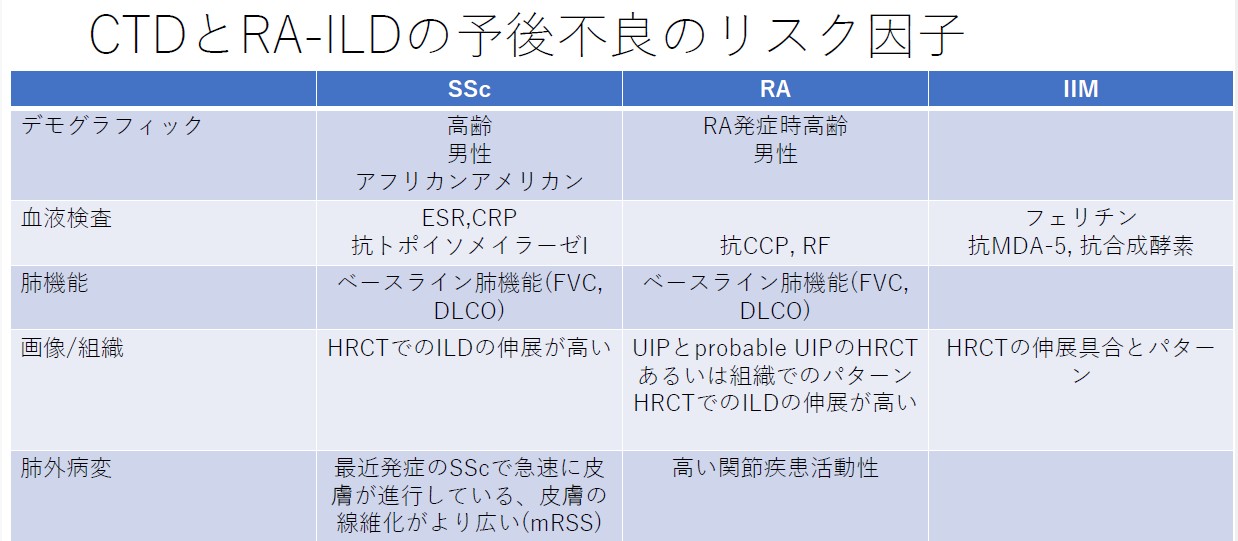
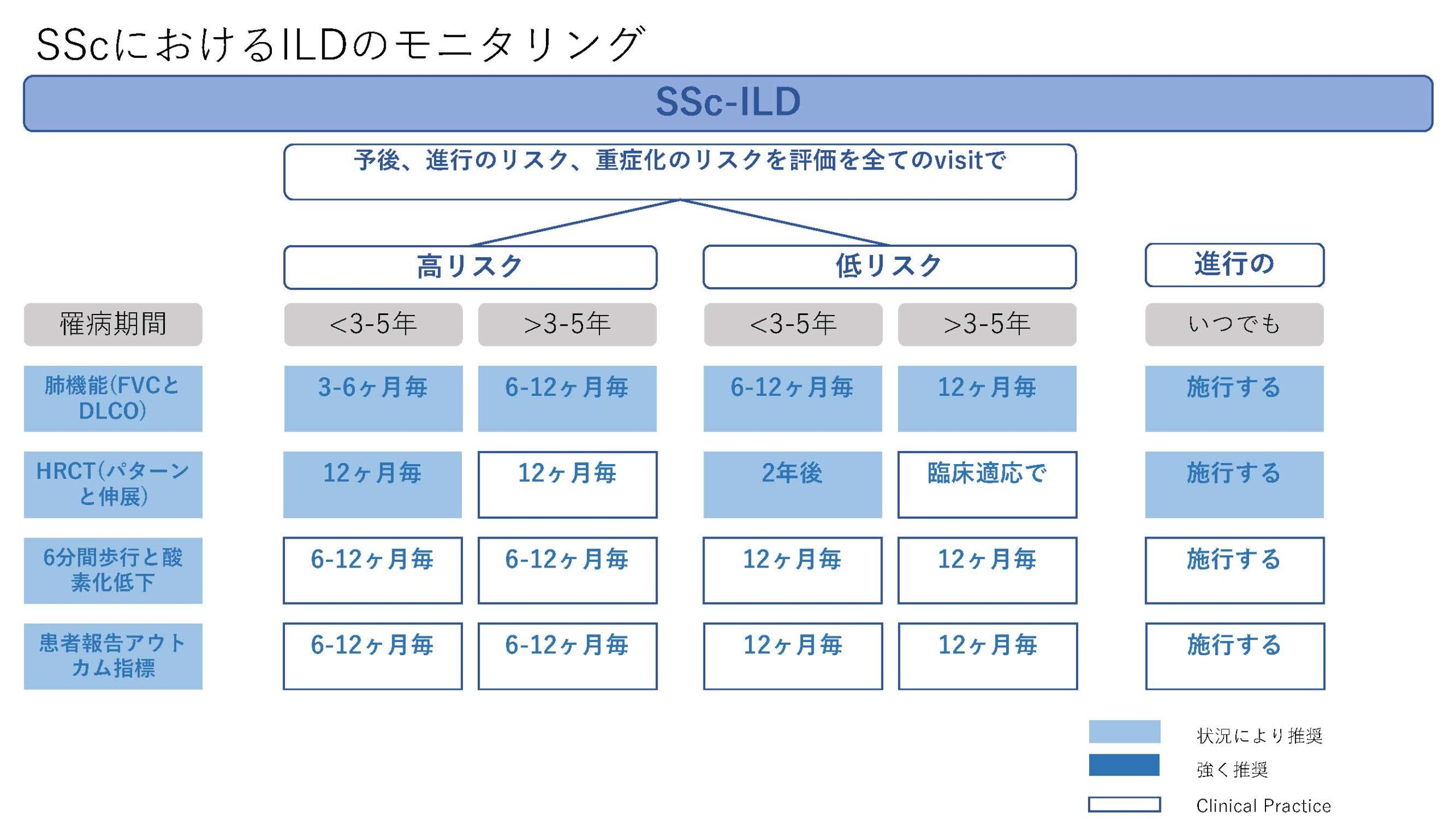
今回、CTD-ILDに関してはEULAR初めての推奨が発表された。オスロ大学のHoffman-Vold医師が発表していた。全身性強皮症(SSc)、混合性結合組織病(MCTD)、炎症性筋疾患(IIM)、関節リウマチ(RA)やシェーグレン症候群(SjD)に伴う間質性肺炎のスクリーニング、モニタリングから治療に至るまでがカバーされていた。ILDのスクリーニングに関してはSSc、MCTD、IIMでは全員がHRCTでのスクリーニングが推奨されていた。RAやSjDでは、リスク因子を持つ患者に関してのHRCTによるスクリーニングが推奨されていた。それぞれのリスク因子に関しては表に記載されているので参照にしていただきたい。ILD診断時には感染症を除外する為やある種の悪性腫瘍の診断(低悪性度のリンパ腫、MALTリンパ腫)、肺胞出血を除外するなど、他の除外すべき疾患が疑われる際には気管支鏡による肺胞洗浄にて微生物検査や細胞診が使われることが考慮されるが、ルーチンには必要ない。また、肺生検もILDの診断での役割はないが、HRCTで通常と異なる特徴があるときや悪性腫瘍を除外する際には使われるかもしれないと記載されている。また、ILD診断時には予後不良を示唆する臨床リスク因子、肺機能、HRCT(パターンと伸展)、6分間歩行、患者指標アウトカムを評価することが勧められている。各疾患ごとのモニタリングもリスク毎、診断後の期間、検査のモダリティー毎に述べられているので図を参照にしていただきたい。治療に関しても、疾患毎にさまざまなケースシナリオ毎に応じたアルゴリズム化されて示されている。まだまだ、エビデンスの少ない部分であるだけに日常診療の手助けになるであろう。部分的に簡単に触れておくと、SSc-ILDの場合ミコフェノール酸(MMF)やトシリズマブが推奨され、進行性の線維化を伴う場合にはニンテダニブの使用が提案されている。RA-ILDの場合、活動性の関節炎がある場合はアバタセプトやリツキシマブ、JAK阻害薬などが推奨されている。IIM-ILDでは、グルココルチコイドを含むカルシニューリン阻害薬、リツキシマブなどが推奨されており、急速進行例では、シクロホスファミドやリツキシマブなどを組み合わせた強力な治療も考慮される。また、疾患の種類を問わず進行性肺線維症を呈する場合には、ニンテダニブの使用が提案されている。(追記:9月4日に正式にAnnals of the Rheumatic Diseasesにこの推奨は発表されております。正確な情報はそちらをご参照ください)
表1)ERS/EULAR Clinical Practice guidelines for connective tissue disease associated interstitial lung disease

★2025 EULAR recommendations for the management of SLE with kidney involvement
EULARとERS共同の推奨であり、最初に2012年、そして2019年にupdateされたものの最新版となる。(表2)
(追記: 2025年10月16日にonline firstでpublishされたため、詳しくはそちらを参照にしていただきたい。)
表2) EULAR推奨 SLEの腎病変のマネージメント 2025update



★EULAR Point to Consider for the Definition of Difficult to Treat Psoriatic Arthritis (D2T PsA)(表3)
関節リウマチではEULARで既にdifficult to treat(D2T)の定義が行われており、それに沿った臨床研究も多く発表されている。今回はGRAPPAも取り組んでその枠組みを発表したが、EULARの乾癬性関節炎における同様の疾患概念の定義に関しての発表があった。この際に、Difficult to ManageとTreatment Refractoryの二つの定義が提唱されている。Difficult to Manageは炎症によるもののみではなく、併存疾患や心理社会的要因などのいずれが原因によってでも疾患のコントロールが難しいものも含むのに対し、Treatment Refractoryはより狭義で、炎症による兆候にのみ治療抵抗性を示すことが定義となっている。どちらも、2種類の異なる作用機序の生物学的製剤/標的合成抗リウマチ薬を使用した際に疾患が十分にコントロールできていない際に定義を当てはめることとなる。
表3 )EULARコンセンサスによるD2MおよびTR PsAの定義

★EULAR Classification Criteria for haemochromatosis arthropathy(表4)
ヘモクロマトーシスは鉄過剰により様々な全身の臓器症状が出る疾患であり、遺伝性のものは白人では見られるものの、日本人には珍しい病気である。CPPDを起こすことで有名であるが、これらに対する研究は分類基準がないために進んでこなかったという背景もあり、今回、分類基準が作成されるに至った。
表4 )EULAR ヘモクロマトーシス関節症 分類基準

★EULAR recommendations for the Management of Rheumatoid Arthritis: 2025 Update(表5)
3年ごとに改定されているEULARの関節リウマチのマネージメントの推奨であるが、2025年の改訂が発表された。特に大きな変更はなかったが、推奨は全てで9つへと集約化された。二つあった推奨文が一つにまとめられたというような形での推奨数の減少であり、本質的な変化はないと考えられる。その中でも変わった点を挙げると、以前は1剤目のcsDMARDで治療が不十分な場合、予後不良因子がないような場合は、csDMARDの追加、予後不良因子があるような場合は生物学的製剤やJAK阻害剤の追加という形であったが、今回の改定では予後不良因子の有無に関わらず、最初のcsDMARDで不十分な場合には生物学的製剤やJAK阻害剤を追加していくこととなった点が挙げられる。また、減薬に関しても以前はグルココルチコイド中止後に寛解が持続している場合に考慮されることがあるとの記載であったが、今回の推奨では基本的には継続を推奨しており、減薬も考慮しても良いとなった。
表5) EULAR推奨 関節リウマチのマネージメント 2025 update


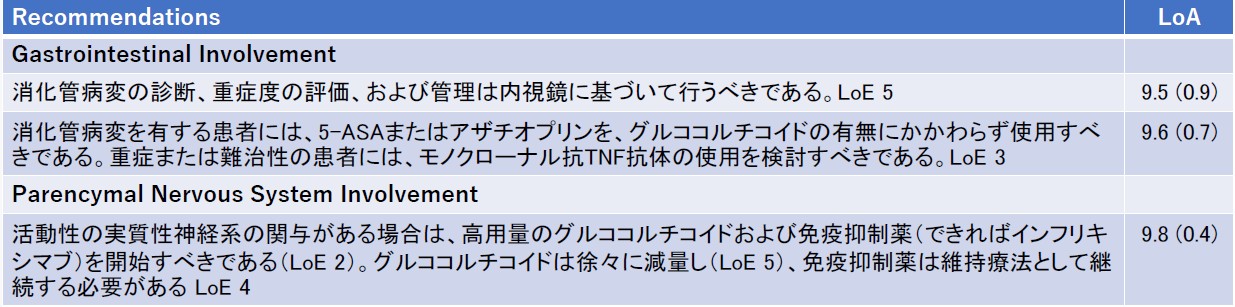
★Update of the EULAR recommendations for the management of Behcet’s Syndrome(表6)
ベーチェット病のEULARの推奨は2018年に最終的な推奨のupdateが発表されている。2018年の推奨では包括原則が5つと様々な領域に対しての推奨で成り立っていた。今回の推奨では前回と同様に、包括原則並びに皮膚粘膜、関節、眼、静脈、動脈、消化管、中枢神経の7つの領域に対する推奨から成り立っている。その推奨を表にまとめて提示する(表6)。今回の変更ではTNF阻害薬の果たす役割が大きくなっていることが感じられる内容である。
EULAR/PReS endorsed recommendations for the management of familial Mediterranean fever (FMF): 2024 updateはAnnals of the Rheumatic Diseases 2025;84:899-909に発表されているのでそちらを見ていただければと思う。
EULAR-ACR Classification Criteria for Antisynthetase Syndrome (CLASS)はACR2024でも発表されており、その旨をACR速報2024で報告しているので参考にしていただきたい。(https://www.rheuma-net.or.jp/senmon/jrfn/2130/)
表6 )EULAR推奨 ベーチェット病のマネージメント update2025


2.Still病のWIN(What is New?) セッションから
ボストン小児病院のPeter A. Nigrovic医師が、Still病に関する最新の知見と今後の展望を包括的に講演した。本稿では、疾患概念の歴史的な転換から、病態解明の深化、そしてそれに伴う治療戦略のパラダイムシフトに至るまで、本講演の要点を詳述する。
講演の冒頭では疾患概念の変遷について述べられていた。元々Still病は16歳を境界に小児発症の「全身型若年性特発性関節炎(sJIA)」と成人発症の「成人発症スチル病(AOSD)」に分類されてきた。しかしながら、この年齢による区分が生物学的根拠に乏しく、恣意的に定められたものである。2024年に発表されたEULAR推奨でも、両者は臨床症状、検査所見、そしてIL-18をはじめとするバイオマーカーにおいて本質的な差がなく、年齢スペクトラム上に存在する単一の疾患であるStill病として捉えるべきであるとされている。次に、病態の理解に関して概説された。Still病は自然免疫系の異常が主体の「自己炎症性疾患」とされてきたが、これが単純なモデルではないことという複数のエビデンスが解説された。最初に二相性仮説が説明された。 スチル病は、初期にはIL-1などが主導する自己炎症的な側面が強いが、慢性化する過程でT細胞などの獲得免疫系が関与する自己免疫的な特徴を併せ持つようになるという「二相性仮説」が提唱されている。その根拠として、①多くの自己炎症性疾患と異なり自然寛解しうること、②獲得免疫に関わる遺伝子HLA-DRB1との強い関連があること、③動物モデルにおけるT細胞の関与、④一部患者における抗IL-1Ra自己抗体の存在などが挙げられた。そして、重要な病態であるマクロファージ活性化症候群(MAS)とStill肺(Still’s Lung Disease: Still’s-LD)に関して最新の知見が解説された。MASの病態解明は著しく進展している。特にインターフェロンγ(IFN-γ)がその中心的役割を担い、「サイクリングリンパ球」と呼ばれる活性化T細胞集団がその主要な産生源であることが特定された。興味深いことに、MASのトリガーとして知られるEBウイルス感染症でみられる「異型リンパ球」が、このサイクリングリンパ球と同一である可能性が示唆された。この知見は、IFN-γやそのシグナル伝達に関わるJAK経路を標的とする治療(エマパルマブやJAK阻害薬)の理論的根拠を強固にするものである。そして最後にStill肺に関して解説された。スチル肺は、IL-1/IL-6阻害薬による薬剤性過敏症症候群(DRESS)ではないかという仮説が提唱され、FDAもこれらの薬剤の添付文書にDRESSのリスクと「発症時は薬剤を中止する」よう警告を追記した。しかし演者は、①薬剤未投与例でもスチル肺が発症していること、②DRESSとは潜伏期間が異なることなどから、この仮説に強く反論していた。安易に「DRESS」と診断し、有効なIL-1/IL-6阻害薬を中止することは、かえって患者の予後を悪化させる危険な判断であると警鐘を鳴らした。むしろ、IL-1/IL-6阻害薬による治療を継続しつつ、JAK阻害薬などT細胞を標的とする薬剤を上乗せする治療戦略が有望であることが、シンシナティ小児病院のコホート研究で示されていることを述べていた。本講演では、スチル病が年齢の壁を越えた単一の疾患として再定義され、その治療戦略がステロイド中心から早期の生物学的製剤導入へと大きく転換したことを明確に示した。特に、MASやスチル肺といった重篤な合併症に対しては、病態に基づいた新たな分子標的治療が次なるブレークスルーとして期待される。
3.CAR T細胞治療を超えて
近年、自己免疫疾患治療においてB細胞を標的とする戦略は目覚ましい進歩を遂げている。特にCAR-T細胞療法は、一部の難治例において劇的な効果を示し、「治癒」への期待を高めた。しかし、CAR-T細胞療法は個別化された細胞製造プロセスや特有の毒性管理といった課題も抱えている。このような背景のもと、EULAR 2025の本セッションでは、CAR-T細胞療法以外の、特に抗体医薬などの「off-the-shelf」な非細胞性B細胞標的療法に焦点を当て、その最新の開発状況と2025年に向けた展望が議論された。従来の抗CD20抗体リツキシマブによるB細胞除去療法は重要な役割を果たしてきたが、その効果の限界、特に組織レベルでのB細胞除去の不完全性が認識されるようになり、より深く、あるいは異なる作用機序を持つ新たな治療戦略の開発が加速している。
まず、Prof. Hans Ulrich Scherer は、主に関節リウマチ (RA) における非細胞性B細胞標的療法の進展について概説した。リツキシマブはRA治療に革命をもたらしたが、全ての患者で十分な効果が得られるわけではなく、組織、特にリンパ組織や滑膜におけるB細胞除去が不完全であることが、効果減弱や再燃の一因と考えられている。OcrelizumabやOfatumumab、Obinutuzumabといった次世代抗CD20抗体は、より強力なB細胞除去能を持つよう設計されたが、感染症リスクの懸念や開発戦略上の理由から、RA領域での展開は現時点で限定的である。また、B細胞の生存・分化に関わるBAFFやAPRILを標的とする薬剤 (Belimumabなど) は、主に全身性エリテマトーデス (SLE) で成功を収めたものの、RAにおいては十分な有効性を示すには至らなかった。これは、RAの病態におけるB細胞の役割が、単なる生存シグナルの遮断だけでは制御しきれない複雑さを持つことを示唆している。 このような状況下で、新たな作用機序を持つ薬剤としてT細胞エンゲージャー (TCE)、特にバイスペシフィック抗体 (BiTE) が注目されている。CD3-CD19 BiTEであるBlinatumomabは、T細胞をCD19陽性のB細胞 (形質芽球を含む) に動員し、細胞傷害を誘導する。ドイツ・エルランゲン大学のグループによる多剤抵抗性の難治性RA患者6例を対象とした小規模試験では、Blinatumomabの低用量持続投与により、全例で寛解導入に成功するという非常に有望な結果が示された。これは、従来の治療法では達成困難であった深い臨床的寛解をもたらす可能性を示唆する。また、形質細胞マーカーであるBCMAを標的とするCD3-BCMA TCEであるTeclistamabも、RA患者での初期の有効性が報告されており、形質細胞を含むより広範なB細胞系列の除去がRA治療に寄与する可能性を探る動きが出ている。Prof. Schererは、リツキシマブが依然としてRA治療の基盤であるとしつつも、TCEのようなより深く、あるいは異なるB細胞サブセットを標的とする非細胞性治療が、2025年に向けてRAの寛解導入・維持における新たな、そして強力な選択肢となる可能性を強調した。
次に、Prof. Jacques-Eric Gottenberg は、全身性自己免疫疾患における非細胞性B細胞標的療法の多様な戦略について解説した。全身性疾患では、RA以上にB細胞の役割が多岐にわたり、それに応じて治療戦略も多角化している。 B細胞除去療法においては、次世代抗CD20抗体である Obinutuzumab が、リツキシマブよりも強力なADCC活性などを有し、リツキシマブ抵抗例を含むSLE、シェーグレン症候群、ANCA関連血管炎などで有望な結果を示している。さらに、CD19を標的とする Inebilizumab は、CD20陰性となりうる形質芽球や一部の形質細胞も標的としうる点が特徴であり、深い末梢B細胞除去をもたらす。既にNMOSDやIgG4関連疾患で承認されており、全身性強皮症 (SSc) における皮膚硬化改善を示唆するデータも紹介された。 B細胞除去だけでなく、B細胞の活性化や機能を精密に制御するアプローチも重要である。T細胞とB細胞の相互作用に不可欠な CD40-CD40L経路の阻害薬 として、抗CD40抗体 Iscalimab や抗CD40L抗体 Dazodalidep が、特にシェーグレン症候群において有望な臨床試験結果を示している。また、B細胞受容体シグナル伝達の鍵分子であるBruton’s tyrosine kinase (BTK) を阻害する BTK阻害薬 は、経口投与可能である点が魅力である。Rilzabrutinib がIgG4関連疾患で、Remibrutinib がシェーグレン症候群で有効性を示唆するデータが報告された。 さらに、自己抗体産生の主役である形質細胞を標的とする戦略も進んでいる。形質細胞の生存に重要なサイトカインであるAPRILを阻害する Telitacicept は、SLEやシェーグレン症候群で有効性が確認されている。加えて、病態に直接関与する自己抗体や免疫複合体を除去する目的で、IgGの半減期を制御する新生児Fc受容体 (FcRn) を標的とする FcRn阻害薬 (Nipocalimabなど) が開発され、シェーグレン症候群を含む複数の自己免疫疾患で有効性が示されている。Prof. Gottenbergは、全身性自己免疫疾患の治療が、単一のB細胞除去から、B細胞の活性化段階、形質細胞、さらにはその産物である自己抗体まで、病態に関わる多様な側面を標的とする、より洗練された戦略へと移行しつつあることを示した。
最後に、Prof. Georg Schett は、特にTCEに焦点を当て、自己免疫疾患治療におけるその可能性と課題について深く掘り下げた。彼は、B細胞除去療法の効果を「Low (低)」「Moderate (中)」「High (高)」のレベルで概念化し、従来の抗CD20抗体ではLowからModerateレベルの除去に留まることが多いのに対し、CAR-T細胞療法はHighレベルの深い除去を達成し、「免疫リセット」による治癒の可能性を示したと述べた。TCEは、CAR-Tと同様にHighレベルのB細胞除去を目指せる薬剤ベースの治療法として位置づけられる。 Prof. Schettは、Blinatumomab (CD19 x CD3) のRAにおける詳細なデータを再度提示し、その高い臨床効果と深いB細胞除去能を強調した。一方で、治療中止後の再燃は避けられない場合があり、持続的な治療や他の薬剤との併用、あるいはより最適な投与法の検討が必要であることを示唆した。また、SScでのBlinatumomabの症例報告にも触れ、その応用範囲の広がりを示した。Teclistamab (BCMA x CD3) に関しては、多発性骨髄腫での使用経験を踏まえつつ、SSc、シェーグレン症候群、皮膚筋炎、RA、多発性硬化症といった多様な難治性自己免疫疾患患者における有効性を紹介した。特に、形質細胞除去による血清遊離軽鎖やIgGの低下、そして疾患特異的な自己抗体価の著明な低下は、このアプローチのユニークな利点として強調された。さらに、Mosunetuzumab (CD20 x CD3) のRAでの初期データも示し、CD20を標的とするTCEも有効な選択肢となりうることを示唆した。 しかし、TCEの導入には慎重さも必要である。組織レベルでのB細胞除去がCAR-Tほど完全かはまだ不明であり、T細胞の過剰な活性化に伴うCRSや神経毒性 (ICANS) は重要な管理課題である。自己免疫疾患においては、がん治療よりも低い用量から開始し、慎重に漸増するプロトコルが採用されている。また、長期投与におけるT細胞疲弊が効果減弱につながる可能性も考慮すべき点である。Prof. Schettは、これらの課題を認識しつつも、TCEが自己免疫疾患治療に大きな変革をもたらすポテンシャルを持つと結論付けた。
本セッションを通じて、非細胞性B細胞標的療法が、除去深度の向上 (TCEによる深い除去)、標的細胞の拡大 (CD19、BCMAによる形質芽球・形質細胞へのアプローチ)、そして機能制御の多様化 (BAFF/APRIL、CD40/CD40L、BTK、FcRn阻害) という点で、著しい進化を遂げていることが明らかになった。特にTCEは、CAR-T細胞療法の有効性に匹敵する効果を、より簡便な「off-the-shelf」の薬剤で達成できる可能性を示しており、難治性自己免疫疾患に対するブレークスルーとなることが期待される。2025年に向けて、これらの新たな治療法が臨床現場に導入され、疾患の特性や病態、個々の患者背景に応じた、より効果的で個別化された治療戦略の実現に貢献することが予想される。安全性プロファイルのさらなる解明と、最適な使用法の確立に向けた今後の研究開発が極めて重要となるであろう。
4.個人的に興味を惹かれた発表や研究結果
口演
LB0002 アプリによる体軸性脊椎関節炎への介入
Axiaはいくつかの機能を持ったアプリである。250を越える異なる運動プログラムのビデオを患者さんに合わせて提供するアルコリズムを持ち、患者さん向けの疾患特異的な知識のアカデミーや、症状日記や疾患マネージメントツール、治療アドヒアランスの向上のためにゲーム要素を入れるなどの工夫が凝らされている。200人の参加者を1:1に割り付け、A群はアプリ使用、B群はアプリ使用なしで12週間観察の後、B群はアプリの使用を開始、A群はさらにアプリの使用を続ける群と、介入後の状態を見る群の二つに分けられ、26週目までの14週間観察が続けられた。その後、アプリ使用を続けた群のみ追加で26週間の経過観察が行われた。主要評価項目はBASDAI、ASQoL、BASFIである。18歳以上の体軸性脊椎関節炎が確認された患者で少なくともBASDAIがスクリーニング時に3.5あり、スクリーニングの8週間前から治療が変更なく行われており、中程度の運動療法を行っている者で、アプリなどのデジタルスキルがあるものが対象となった。アプリ使用群は95名、アプリ非使用群は91名が、12週までの観察を終了した。平均50歳程度、6-7割程度が女性で、BASIDAIが5を越え、NSAIDsは5-6割程度、生物学的製剤やJAK阻害薬を使用しているものも5-6割いるという患者集団であった。主要評価項目であるBASDAI、BASFI、ASQoLともに介入群で有意な減少が認められた。ASAS20やASAS40にも改善が見られ、ASAS20に関しては介入群では51%、非介入軍では9%、ASAS40に関してはそれぞれ23%と3%と、これらも統計学的に有意に差を認めた。デジタルツールで病勢の改善を示すことのできた初めての例ではないかと考えられる。今後、多言語にも訳される予定であるとのことたが、12週以降の結果も気になるところである。
OP 0069 GLP1受容体作動薬はJAK阻害薬使用者の心血管イベントのリスクを減らせるのか
JAK阻害剤使用者における心血管イベントが注目を浴びるようになって数年が経っている。当初のoral surveillance試験のサブ解析も多く行われ、その中でスタチンの非使用がJAK阻害剤の使用者の中での心血管イベントのリスクになる可能性が指摘されている。今回の研究ではTriNetXという大規模リサーチプラットフォームを用いた後方視的研究にて、JAK阻害剤使用者における心血管イベントのリスクがGLP1受容体作動薬が保護的な効果を持つか検証したものである。40歳以上のRA患者で、JAK阻害剤をGLP-1受容体作動薬を使用している患者、ならびにGLP-1受容体作動薬使用なしの患者を同定、プロペンシティースコアマッチングでベースラインをそろえた2449名ずつの患者のグループが比較された。5年間の期間で急性冠症候群、脳梗塞、急性末梢動脈血栓症、深部静脈血栓/肺塞栓、ならびに動脈心血管イベント全体に関して検討された。心血管イベント全体ではGLP-1受容体作動薬使用群で5.3%、非使用群で7.9%と有意にGLP-1受容体作動薬使用群でのイベントが少なく、個々の事象では、急性冠症候群(GLP-1受容体作動薬使用群:4.0%, GLP-1受容体作動薬非使用群:6.21%)、深部静脈血栓/肺塞栓GLP-1受容体作動薬使用群:3.7%, GLP-1受容体作動薬非使用群:5.4%)において有意差が見られた。GLP-1受容体作動薬の血管に対する作用機序、抗炎症作用など様々な機序の可能性が考えられる結果であった。少なくとも、JAK阻害薬を使用しなければならない患者において、糖尿病がある場合の治療薬の選択肢としての付加価値が示せるか今後のさらなるデータが気になるところである。
OP0105 回帰性リウマチにおけるアバタセプトとヒドロキシクロロキンの比較
回帰性リウマチは間欠的に関節や関節周囲の炎症が出現し、その中で関節リウマチへ移行していく者もいる関節リウマチの前段階とも考えられている疾患である。特に、RFやACPA陽性者では高率に関節リウマチへ移行していく。PALABA試験と名付けられたこの試験は、18歳以上の回帰性リウマチ患者で、RFまたはACPAが陽性、疾患の期間が3ヶ月以上3年未満の者を対象とし、アバタセプトまたはヒドロキシクロロキンどちらが関節リウマチへの移行(2010年ACR/EULAR分類基準)を防げるかを24ヶ月観察したスペインで行われたランダム化比較試験である。36名がヒドロキシクロロキンに割り当てられ、34名がアバタセプトに割り付けられた。24ヶ月で関節リウマチに進展したのはヒドロキシクロロキン群で27.8%、アバタセプト群で8.8%と有意にアバタセプト群で少なかった。12ヶ月以内に発作が1回未満という寛解の基準を満たせたのは、ヒドロキシクロロキン群で22.9%、アバタセプト群で55.9%とこちらもアバタセプト群が有意に高かった。
OP0190 迷走神経刺激は関節リウマチを改善させるのか
迷走神経刺激による神経免疫調整により関節リウマチの疾患活動性を抑えることを目的とした試験である。この試験で使用された埋め込み型の機器は2cc程度の堆積で、全身麻酔下で外来にて60-90分で埋め込みが可能である。全員の被験者に機器を埋め込み、刺激群では60秒の刺激を毎日、シャム群では刺激をせずに12週間観察、その後は両群共に60秒の刺激を毎日受け24週まで経過をフォローされた。対象となった患者は年齢の中央値が50代半ば、腫脹関節数が10程度、DAS28で平均5.4−5.5と疾患活動性が高く、2剤以上生物学的製剤あるいはJAK阻害薬を使っている方が60%程度であった。主要評価項目である12週時のACR20達成率は、治療群でsham群よりも有意に高く、12週以降はsham群も治療群となり、24週では両群の治療反応はだいたい同じぐらいになっていた。RESET-RA試験の結果をもとに、アメリカのFDAはこの医療機器を2025年に承認した。
ポスター発表
POS0472 MRIでの腱鞘滑膜炎の体積はRA発症の予測因子になるか
Pre-RAの介入試験が多く行われてきたが、プラセボ群の発症率を見ると50%程度である。Pre-RAで介入対象とするハイリスク群の予測はリウマチ因子や抗CCP抗体の存在のみでは不十分であることが示唆される。ACR/EULARの関節リウマチ発祥のリスク分類の基準が2025年に発表されたが、ここでは臨床基準を中心に考えられており、追加でMRIの腱鞘炎がさらに予測の精度を上げることが記載されている。
今回のポスターでは、臨床的関節炎を未発症の抗CCP抗体陽性者(リスク群)223名を対象とした前向きコホート研究にて、手首およびMCP関節の造影MRIを用い、腱鞘滑膜炎ボリューム(TSV)を定量的に評価し、その後の臨床的関節炎(RA)への進行との関連が検討されている。追跡期間中央値15.3ヶ月で、全体の25.6%(57名)が臨床的関節炎を発症した。ベースラインのMRIでは54.3%に腱鞘滑膜炎が認められた。ベースラインのTSVは、後に関節炎へ進行した群(1607 μL)が、進行しなかった群(727 μL)と比較して有意に高値であった(p=0.003)。Kaplan-Meier解析でも、TSV高値群(>1000 μL)は有意に早期発症した。多変量Cox回帰分析の結果、TSV(HR=1.45, p<0.001)および圧痛関節数(HR=1.07, p=0.014)が、他の臨床・画像マーカー(滑膜炎ボリューム等)とは独立した予測因子であることが示された。
OS0483 プロバイオティクスで関節リウマチの疾患活動性が改善するのか
セルビアからの報告である。新規診断された関節リウマチ患者さん100名に対して、csDMARDに加えてプロバイオティクスを用いて治療した群と、csDMARDのみの治療を行った群を比較した単施設前向き二重盲検ランダム化プラセボ比較試験である。プロバイオティクスは、Lactobacillus casei BLn2401, Lactobacillus slivarius BL2201, Bifidobacterium breve BL3406を含むものであった。この試験の12ヶ月時点でのDAS28はプロバイオディクス群では2.3±0.4、プラセボ群では4.8±0.7であり、Cox regressionモデルでの解析でも、寛解の予測因子として、性別、年齢、喫煙、RF/抗CCP抗体、ESR, CRPは有意ではなく、プロバイオティクスのみがハザード比で2.703 (95%信頼区間:1.59-4.60)有意な結果となった。
POS0960 巨細胞性動脈炎の長期予後
ギリシアからの報告である。241名の巨細胞性動脈炎の患者を追跡した結果である。死因としては心血管イベント(死因の中の27%)、感染症(11%)、悪性腫瘍(7%)であった。死亡率はこのコホートでは19.9/1000人・年であった。多変量解析では、DMARDの使用が死亡率を低下させる要因として唯一関連するものとして出てきた。GCAにおいて治療が死亡率を下げるというデータは今までなかっただけに、今後、他のコホートにおいても同様のことが証明されることが望まれる。
POS1093 H症候群の特徴
H症候群は、SLC29A3遺伝子の病的変異に起因する稀な遺伝性疾患である。組織球の活性化制御異常に伴う自己炎症性疾患であり、組織球増多症の一群に分類される。
本報告は、フランスの多施設共同コホート研究(33例、追跡期間中央値23年)の結果である。本研究により、H症候群が自己炎症、自己免疫、免疫不全、線維化傾向を併せ持つ複雑な病態であることが示された。臨床症状は多彩で、難聴(70%)、浸潤性病変(71%)、リンパ増殖性症状(69%)、皮膚症状(65%)、関節症状(57%)が高頻度であった。他にも眼、内分泌、心、腎、肺など多臓器にわたる症状が認められた。検査所見では、87%に炎症反応上昇、70%に高ガンマグロブリン血症を認めた。また、25%の患者で自己抗体(糖尿病関連、抗SS-A抗体など)が検出された。治療面では、ステロイドの効果は限定的であった。一方、IL-6阻害薬(トシリズマブ)は発熱、腱鞘炎、炎症症状に、MEK阻害薬(コビメチニブ)は浸潤性病変に対して有効性が示唆された。
以上限られたスペースの中での報告となったが、日々の臨床に役立つ情報が満載された会議であった。2026年のロンドンでのEULARも楽しみである。
